螺旋藻“披上”磁性外衣,浙大微纳机器人借光合作用靶向治疗肿瘤
微纳机器人具有灵活运动、精确靶向、药物运输等能力,在疾病诊断治疗、靶向递送、无创手术等生物医学领域具有广阔的应用前景。然而现阶段针对微纳机器人在生物医学领域的有关研究大多聚焦在体外水平,在活体水平的应用仍然具有极大的挑战性。
浙江大学医学院附属第二医院/转化医学研究院周民研究员团队研制出一款微纳机器人,通过以微型螺旋藻作为活体模板,“穿上”磁性涂层外衣,靶向输送至肿瘤组织,成功改善肿瘤乏氧微环境并有效实现磁共振/荧光/光声三模态医学影像导航下的肿瘤诊断与治疗。这项研究被刊登在材料领域著名期刊《先进功能材料》(AdvancedFunctional Materials),并被遴选为当期副封面。
肿瘤组织的微环境,尤其是肿瘤组织内部存在的乏氧微环境,是导致众多肿瘤治疗方法出现耐受现象的重要原因之一。特别是在临床上常用的放射性治疗中,氧气参与辅助电离辐射诱导的DNA双螺旋结构的损伤,促使细胞凋亡,缺氧会影响放疗效果从而导致肿瘤细胞的耐受性。因此,如何有效减轻或逆转肿瘤的乏氧状态,是增强放射性治疗效果的重点研究内容。
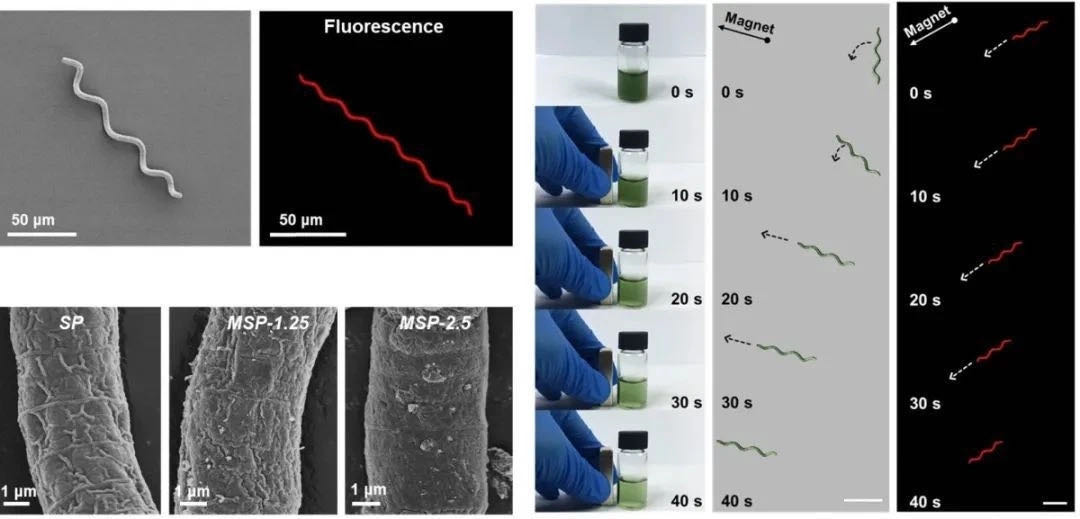
工程化螺旋藻,可通过外部磁场控制下能定向移动
该体系是一种光合生物杂交体系统,这个系统既保持了微藻高效的产氧活性,还兼有四氧化三铁纳米颗粒的定向磁驱能力。
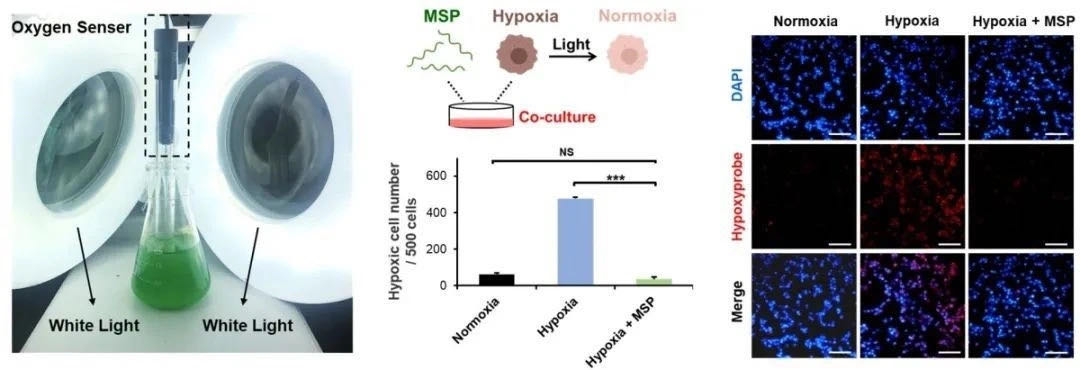
工程化螺旋藻可通过光合作用可调节肿瘤乏氧
磁性工程化PBNs能够在外部磁场控制下,靶向运动并积累至肿瘤,通过光合作用原位产生氧气来减轻肿瘤内部乏氧程度,从而提高放射疗法(RT)的效率。同时,经射线处理后PBNs释放的叶绿素能作为光敏剂,在激光照射下产生具有细胞毒性的活性氧(ROS),实现协同光动力治疗(PDT)。此外,PBNs除了具有Fe₃O₄涂层带来的优异T2模式磁共振成像功能(MRI)外,还具有基于叶绿素的天然荧光(FLI)和光声成像(PAI)功能,可以无创性地监测肿瘤治疗情况和肿瘤微环境变化。
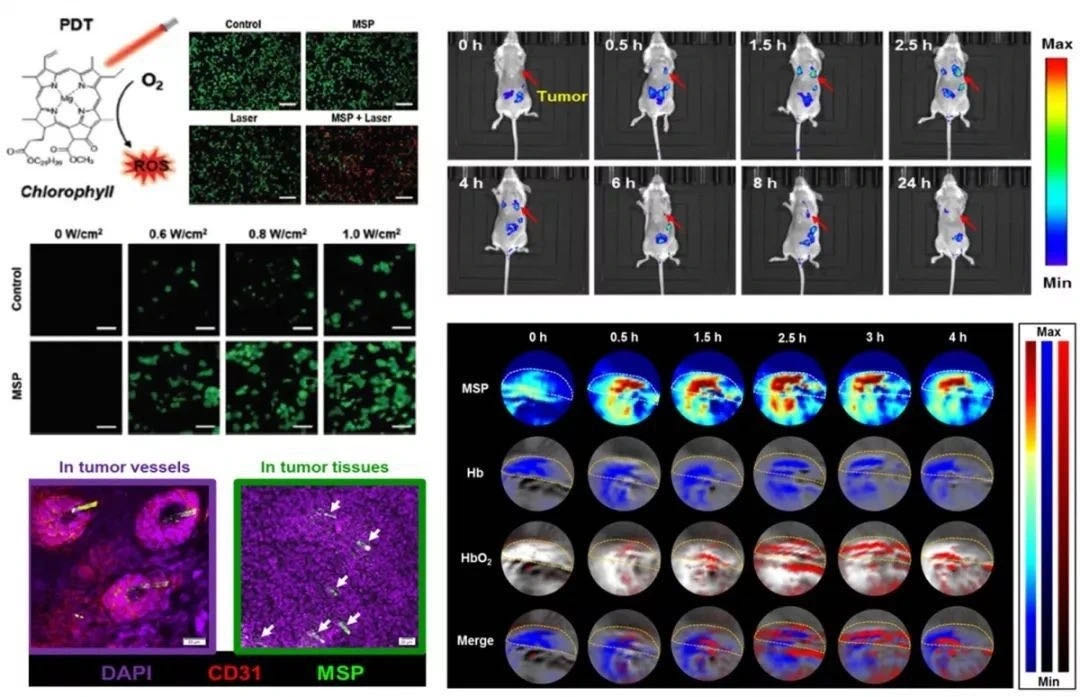
肿瘤靶向、光动力能力及成像功能
在小鼠的原位乳腺癌模型中,经增强的联合治疗展现了明显的肿瘤生长抑制作用。在治疗中,通过体外磁场将微纳机器人靶向运送并积累至肿瘤,通过体外光照,由光合作用原位产生氧气来减轻肿瘤内部乏氧程度,从而提高放射疗法的效率。在小鼠的原位乳腺癌模型中,经增强的联合治疗展现了明显的肿瘤生长抑制作用。
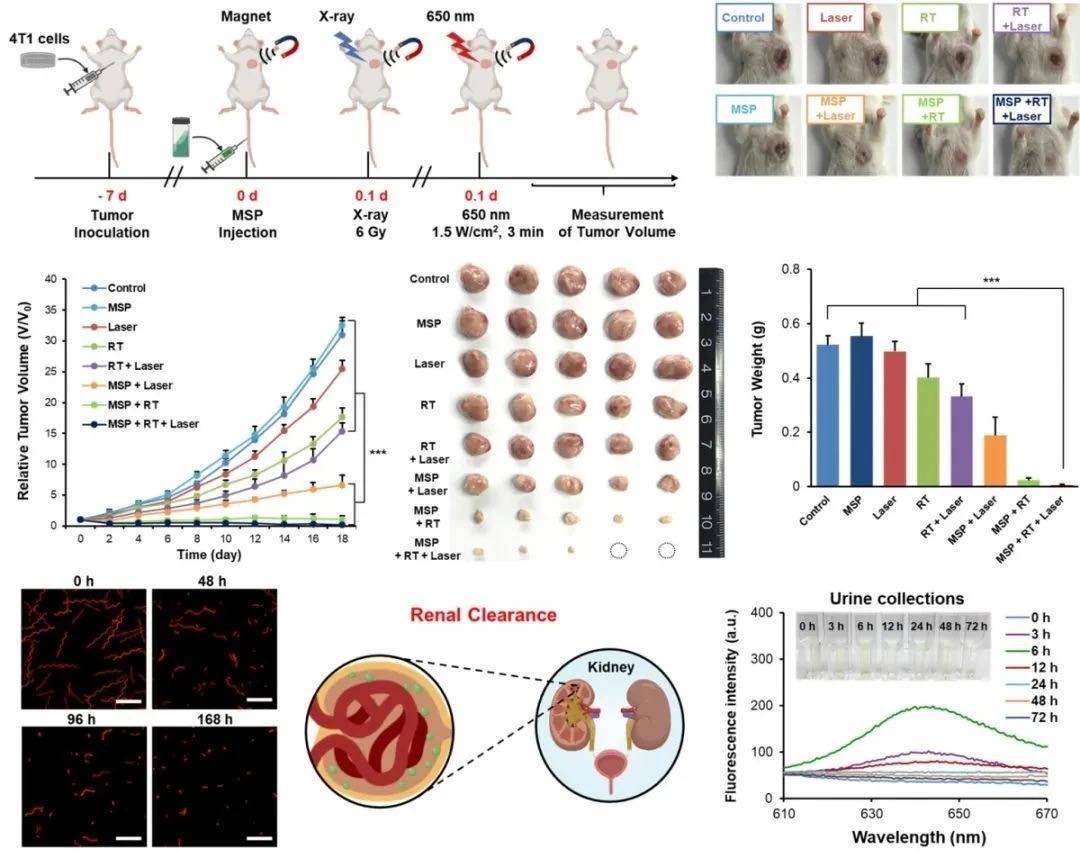
增强放疗/光动力协同治疗抑制肿瘤生长并可以代谢出体外
光合生物杂交微纳泳体系统不仅对于放疗具有积极作用,在经过射线处理后释放的叶绿素能作为光敏剂,进而产生具有细胞毒性的活性氧来杀死肿瘤细胞,实现协同光动力治疗。“正常的光动力治疗需要氧气和活性氧才能顺利开展,目前的微纳机器人能够很好地解决这两个需求。”此外,微藻中含有的大量叶绿素,也具有的天然荧光和光声成像功能,可以无创性地监测肿瘤治疗情况和肿瘤微环境变化。更重要的是,该微纳泳体本质作为天然生物能够在体内得到有效降解,为生物杂化材料应用在靶向递送和体内生物医学中提供了转化前景。该微纳泳体本质作为天然生物能够在体内得到有效降解,为生物杂化材料应用在靶向递送和体内生物医学中提供了转化前景。



