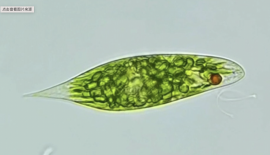
由于天然虾青素(AXT)的安全性、独特结构和特殊功能,以及其在人类健康和多种行业潜在的应用,全球市场对其需求正在迅速增长。目前,雨生红球藻(Haematococcus pluvialis,又名H. lacustris)被认为是天然AXT的最佳规模化生产者之一。然而,该行业的进一步发展面临两个主要挑战:虾青素生产工艺高度依赖高光条件,导致其可规模化生产的区域有限;AXT的低产量特性,以及其复杂、耗时的上游生物质培养和下游提取过程导致的高生产成本。因此,迫切需要制定新的策略来提高雨生红球藻AXT的产量,以满足工业需求,使其商业化成本更高。尽管,目前筛选优秀的目标菌株、优化培养条件以获得高生物产量、阐明AXT的生物合成途径、开发高含量AXT的有效诱导剂等策略已被应用,但仍有一些未解决和容易被忽视的问题。
本文的总结归纳如下:
1. 研究问题: 本文旨在探讨虾青素(ATX)在高脂饮食(HFD)诱导的小鼠脂肪肝和氧化应激中的作用及其机制。
2. 研究难点: 肥胖及其相关代谢疾病是全球范围内常见的健康问题,现有的抗肥胖药物存在副作用和耐受性问题,因此寻找天然、安全的替代品具有重要意义。
3. 相关工作: 现有研究表明,虾青素作为一种天然的抗氧化剂,具有抗炎、抗代谢紊乱等作用,但其对肝脏脂质代谢和肠道菌群的调节作用尚不明确。
研究方法
本文通过动物实验研究了虾青素对高脂饮食诱导的肥胖小鼠的肝脏脂质代谢和氧化应激的影响。具体方法如下:
1. 动物模型: 选用48只雄性C57BL/6小鼠,随机分为正常饮食组(ND)、溶剂对照组和高脂饮食组(HFD),并在高脂饮食组中进一步分为三个亚组,分别给予0.25%、0.5%和0.75%的虾青素处理。
2. 给药方式: 所有小鼠在适应期后进行为期9周的灌胃处理,每日一次。
3. 生理指标检测: 记录小鼠的体重、摄食量和器官重量,测定血清中的甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)水平及肝功能酶活性。
4. 组织病理学检查: 通过苏木精-伊红(H&E)染色、油红O染色和TUNEL凋亡检测等方法评估肝脏和附睾脂肪组织的病理变化。
5. 分子生物学分析: 采用定量聚合酶链反应(qPCR)和转录组学分析肝脏基因表达,利用液相色谱-质谱联用技术(LC-MS/MS)进行脂质组学分析,并通过16S rRNA测序分析肠道菌群多样性。
实验设计
1. 动物分组: 小鼠被随机分为六组,每组八只,分别为正常饮食组(ND)、溶剂对照组、高脂饮食组(HFD)及三个不同剂量的虾青素处理组(HFD+0.25% ATX、HFD+0.5% ATX、HFD+0.75% ATX)。
2. 饲料组成: 正常饮食组喂食标准啮齿动物饲料,高脂饮食组喂食高脂饲料,虾青素通过玉米油溶解后灌胃给药。
3. 样本收集: 在实验结束时,收集小鼠的血液、肝脏、心脏、脾脏、肾脏和脂肪组织,并进行相应的生化分析和组织病理学检查。
4. 数据分析: 使用SPSS软件进行统计分析,数据以均值±标准差表示,组间比较采用Duncan多重范围检验。
结果与分析
1. 体重和摄食量: 高脂饮食组小鼠体重显著增加,而虾青素处理组体重增加较少,且高剂量虾青素效果更明显。各组小鼠的能量摄入无显著差异。
2. 肝脏重量和脂肪沉积: 高脂饮食组小鼠肝脏重量和脂肪沉积显著增加,虾青素处理组肝脏重量和脂肪沉积显著减少,尤其是0.75%虾青素组。
3. 血清脂质和肝功能: 高脂饮食组小鼠血清TG、TC和LDL-C水平显著升高,HDL-C水平降低;虾青素处理组血清脂质水平显著改善,尤其是0.75%虾青素组。
4. 抗氧化指标: 高脂饮食组小鼠肝脏ROS和MDA水平显著升高,抗氧化酶活性显著降低;虾青素处理组ROS和MDA水平显著降低,抗氧化酶活性显著提高。
5. 肝脏病理学变化: 高脂饮食组小鼠肝脏出现典型的脂肪变性、炎症细胞浸润和气球样变;虾青素处理组肝脏病理学变化显著改善,尤其是0.75%虾青素组。
6. 肠道菌群变化: 高脂饮食组小鼠肠道菌群多样性降低,虾青素处理组肠道菌群多样性显著提高,尤其是0.75%虾青素组。虾青素显著抑制了肥胖相关菌群(如Parabacteroides和Desulfovibrio)的生长,促进了有益菌群(如Allobaculum和Akkermansia)的生长。
总体结论
本文研究表明,虾青素通过调节肠肝轴,显著改善高脂饮食诱导的小鼠脂肪肝和氧化应激。虾青素不仅降低了体重和脂肪沉积,还改善了血清脂质水平和肝功能,增强了抗氧化能力,并调节了肠道菌群结构。这些发现为虾青素在预防肥胖及相关代谢疾病中的应用提供了科学依据。
Biotechnology Advances (IF=12.1) 2025-1-10
中国科学院烟台海岸带研究所 崔红利&秦松 课题组
原文及链接:Advancements of astaxanthin production in Haematococcus pluvialis: Update insight and way forward