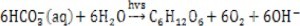藻种培养问题
三角褐指藻变绿色,后来又变成茶褐色可能的原因是什么
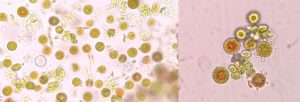
西安汉宝李朝义总经理在开发硅藻浓缩液产品的时候,前阶段培养的三角褐指藻,一瓶浓缩避光保存,两个多月后几乎变成了黄绿色,接近绿色了,刚放在窗台上晒了几小时,很快就变成茶褐色了,这是什么原因?
华南理工大学魏教授:三角褐指藻中岩藻黄素-叶绿素-捕光蛋白是三位一体的FCP。避光保存下捕光色素、光合色素降解,岩藻黄素降解比叶绿素更快,故显黄绿色。见光后开始捕光和光合作用,岩藻黄素和叶绿素快速合成,分子摩尔比相当,但前者颜色更深,遮挡了叶绿素颜色,故显棕色。
深圳大学王教授:这快速变色有没有可能是色素的集中和分散,血红裸藻可以在8分钟内变色,从绿色变血红色,发现是色素的集中和分散。类似变色龙.
华南理工大学魏教授:裸藻是原生功物,进化程度更高,可能代谢调节速度更快。加上细胞体积更大,色素分散可能性更大。但硅藻、金藻中更大可能是合成与分解的调控,速度更慢些。
日常生物中发现甲藻和硅藻变绿,镜检却很干净,可能并不是藻种被污染而是光照或者藻种代谢出现问题,紫外谱段的生理效应,对于生物都那么重要。可以尝试用紫外灯照射刺激一下。日常用三基色激发的荧光灯在藻类培养中有时候效果比强光照LED更有效也可能是激发光有少量的UV紫外波段。
控制哪些条件能维持微囊藻群落形态
控制哪些条件能把采集的自然水样中的微囊藻群落形态在转接过程中维持下来呢?高浓度钙,不要搅拌,低温
如何分散培养成絮状硅藻细胞
硅藻细胞在经过一段时间培养后会变成絮状,一般可以通过搅拌,通气,或者调节pH从高到中性就可以变成单细胞状态。
饵料金藻被污染怎么处理?
发现金藻有污染可以在傍晚用10ppm有效氯杀灭,1小时后用硫代硫酸钠中和余氯,第二天大部分可以恢复活力,也可以投喂,但只能操作一次
微藻半固态保种是什么意思
目前微藻常见保种方式有固态斜面和液态藻液保存。半固态保存就是在一个三角烧瓶里面底部用含培养基的琼脂加上藻液,上面是培养基的一种保存方式。半固态保种适合用于长期保种,几个月更换一次培养基和复壮。转接出来比纯固态容易 不过没纯液体快 优点是细胞增殖慢 遗传相对稳定 种源衰亡退化慢。缺点是成本比纯液态高,比较容易染菌 另外从保种到活化出来用需要一段时间。
小球藻和球等鞭金藻如何浓缩,浓缩液怎么保存效果好?
1、小球藻的浓缩以(80±5)mg·kg-1的明矾液及4%的石灰水效果最好;球等鞭金藻的浓缩以(100±10)mg·kg-1的明矾液及6%的石灰水效果最好。
保存方法以加入保护剂甘油并置于-30℃冰箱中效果最好,小球藻和球等鞭金藻的存活率分别为95%和93%。低温保存前后,藻的高度不饱和脂肪酸(HUFA)的含量变化不明显,用浓缩液投喂中国对虾和轮虫的效果与普通藻无显著差异。
2、项文钰等将小球藻和蛋白核小球藻都分别加入10%、20%、30%的DMSO,以及20%、35%和50%的甘油,保存在-20℃、-75℃和-196℃的液氮中,再各取一些不加任何防冻剂保存在20℃的培养箱里。3个月后取出培养,观察颜色变化并测量其中的叶绿素含量,结果表明:浓缩的藻液可以在20℃下长期保存;小球藻浓缩藻液添加20%的甘油在各种不同的温度下保存效果都很好,其次是10%的DMSO;而衣藻则加入10%的DMSO在各种温度下保存都较好,加入20%的甘油,在液氮中保存的效果最好。浓度大于10%的DMSO和大于20%的甘油对微藻细胞的保藏效果不佳。
培养小球藻中亚硝酸盐含量较高,是什么原因导致的
首先要考虑培养条件是否合适(如温度低),氨氮高加上如果磷酸盐不足,营养不均衡,导致藻类光合作用弱,导致底部氧少,从而加剧亚硝酸盐的积累,恶性循环,其次考虑检测方法是否有盐度干扰等,再次,硝态氮使用过量也可引起亚硝酸含量增加。
f/2培养基配好后需要调pH吗
一般淡水藻的培养基配置好之后要调pH,比如TAP等,但是海水藻培养基一般不调pH,除非配错了,自然海水的pH在8-8.5之间,f/2用海水做溶剂配置好之后不需要专门调pH
扩培的藻种长不好怎么办
网友回复:在原水、培养基和温度都没问题的情况下,我以前养过微囊藻,蓝藻,藻浓度比较低的时候,光太强会死的所以接种我都接的浓度相对稍微高一点,或者亮度比较低,有时候还用报纸挡一下。
雨生红球藻什么情况会变白
室外反应器的雨生红球藻红细胞漂白很多时候出现在夜间,基本都是个别细胞白了不会全白,这种完整的透明细胞形态可以维持10天以上,光太强,光氧化,类胡萝卜素分解了还可以理解,最奇怪的是叶绿素也漂白没了
1、强光诱导下,不补充二氧化碳会变白的;
2、晚上光合作用停止,温度的突然变化也会造成细胞漂白;
3、pH变化也会使得细胞变白;
4、盐诱导过程,浓度不均匀也会造成细胞变白
培养卵囊藻,如何正确使用磷肥?
培养卵囊藻使用磷肥注意,如果使用磷肥品质不好,就会导致藻类生长慢。培养卵囊藻尿素和磷酸氢二钾比例是10:1。如果使用过磷酸钙,因溶解度差,磷含量低,用量要增加2到3倍,也就是尿素和过磷酸钙比例为10:2-3。
注意磷肥质量。
磷酸氢二钾假的多,特别是小塑料袋包装,大多是假货。过磷酸钙要使用白色粉沫,能用于水的产品。使用大厂家的产品。
大规模培养小球藻,有哪些方式?
当前国际上大规模培养小球藻的主要方式,可以概括为:密闭无菌培养,开放半无菌培养,开放藻菌混养。
东海原甲藻和海洋原甲藻的形态区别
东海原甲藻是倒批针心形,海洋原甲藻是心形 顶端有刺
TAP培养基颜色变化的原因
TAP培养基的配置说明中关于Hutner’s trace elements中的初始配置好是绿色 静置一阵子 每天摇动促进溶解 颜色变紫色 曝气 过滤之后 紫红褐色 只要静置不产生沉淀 都可以用,如果配置的颜色变化过程和说明不同顺序或者产生沉淀则说明试剂出错。
TAP培养基中冰醋酸的使用
TAP培养基的浓缩液都会配有一瓶冰醋酸,配置工作液的时候,请先加入按比例加入其他几种母液成分,然后用pH计搅拌,用冰醋酸滴定到pH中性,然后再高温高压灭菌使用.冰醋酸不是用来按比例添加的。
L1-Si (或者 f/2 –Si) 是什么意思?
指的是我们的L1和F / 2不含硅酸盐培养基。硅酸盐可以引起介质中的沉淀,从而抑制某些菌株的生长。硅酸盐只需要培养具有二氧化硅要求的硅藻或其他生物。
培养藻种在使用购买的光语培养基的时候改变其中的配方吗?
可以。请放心使用我们的培养基。你可能会减少不必要的成分,如养硅藻不需要硅酸盐。你可能会改变实验目的增加额外的成分。您还可能希望降低盐度让培养基能生长一些细菌。但是,我们建议如果你不确定配方的时候。我们提供的培养基是最佳的。
培养基里面用碳酸氢铵经济还是尿素便宜?
在传统大规模培养中氮源一般是用碳酸氢铵或者尿素的,从经济角度来说,碳酸氢铵和尿素的含氮量比例是1:2.7。
如果碳酸氢铵的价格是800元/吨,那么尿素低于2160元/吨,就是尿素划算。
加什么试剂可以让盐藻暂时静止(不运动但不失活,目的是为了拍照)
甘油或者低熔点琼脂
如何测定藻细胞油脂含量
对于已经分离了的微藻也可以通过96孔板筛选方法进行快速高通量测定其各种类微藻的油脂含量。通常的做法就是将待测定的微藻分别用96孔板培养240μl,每个样品至少做三个复孔。为了避免边缘效应,96孔板的边沿的微孔应该不加入样品而加入相应的培养基,处理好的96孔板放置于光照培养箱中培养。最后在一定时期内加入1μl浓度为0.5mg/ml的尼罗红染液进行染色10min后在荧光酶联免疫酶标仪中测定荧光强度。尼罗红染色法在一些细胞壁比较薄,柔软的种类中得到很好的应用,如黄藻纲、金藻纲、硅藻纲等。但是对于部分藻细胞壁较厚较严密的微藻类,简单的尼罗红染色法所测能检测到的荧光信号强度并不理想,如绿藻属。这时,如在染色时加入微量的DMSO溶液,可使尼罗红更容易通过藻细胞壁,从而有效增强荧光信号的强度,扩大了尼罗红荧光染色在筛选高产油脂微藻中的应用范围。林义等人将尼罗红染液直接加入到分离培养基,对358株产油酵母进行筛选,在280-300nm紫外光照射下,辨别高产油菌株,并获得产油量高达62.9%的菌株。
如何分离纯化微藻细胞
离心分离:离心分离法利用微藻的离心沉降系数不同而将其分离,一般采用1000-3000转速即可,太高转速虽能将微藻分离,但是高转速容易损伤藻细胞,不易养活,而太低的转速可没能很好的分离藻细胞。一般情况下,在使用其他分离方法之前也可以使用离心分离法将部分杂质去掉,然后再做相应的分离。在无菌操作之下重复用无菌水进行离心分离可以达到纯化作用,而达到纯化作用至少须要重复离心20次。
划线分离:与传统的微生物划线分离一样,利用接种环沾取微藻悬浮液,然后在琼脂平板上划线。最后在人工气候箱中培养一段时间,一般至少须要两周的时间才能长出微藻藻落,再从单个微藻藻落中挑取微藻至于干净灭菌的含有相同成分的液体培养基进行培养。若已得纯种微藻则可以扩大培养。
稀释分离:特定浓度的微藻悬浮液用培养基或者灭菌的蒸馏水进行不断的稀释,直到每一滴液滴中只有一个微藻时即停止。稀释好的微藻悬浮液可以滴在干净的载璃片上,置于显微镜下观察,若视野中即每一滴悬浮液只有一个藻细胞则将其移入事先准备好的培养液中培养,也可以将稀释好的微藻悬浮液直接按照每孔一滴加入到96孔板中培养,然后挑取只有单个微藻繁殖(同一微孔内只有一种微藻)而来的微孔进行扩大培养。
微吸管分离法:微吸管分离法或许是获得单细胞藻类最常用并且最实用的方法了,该方法适用于藻细胞较大的藻类,但微吸管法对试验仪器的要求也相对较高。实验前须将微吸管或者微璃璃点样管在酒精灯火焰处将微观烧软,然后迅速将微管移离火焰并迅速将其拉长,用医学钳子在合适孔径处将其均匀钳断,获得圆滑的微吸管口,并且微吸管口的孔径至少要比所吸取的藻细胞大两倍以上,在吸取藻细胞时须要缓慢,由于流体切变力,过快的吸取速度会导致藻细胞损伤,微吸管口也不可太大,太大就难以吸取单个的目的微藻细胞。毛细管制好之后,将其与2μl、5μl、10μl或者100μl的枪头连接,最后与移液枪连接即可。在使用微吸管分离的时候,使用普通的光学显微镜即可,由于其载物台较低,因此其操作也比较方便,特别是对于新手所遇到的手抖问题。在用微吸管法分离法吸取细胞时,往往须要进行多次分离,自于毛细管作用,须要先将毛细管管头至于灭菌的蒸馏水中,将毛细管浸湿以减少毛细管作用,然后利用已浸湿毛细管在样液中吸取单个微藻细胞,若吸取不止一个微藻细胞,则将吸取液吹打到灭菌干净的蒸馏水中再次重复操作,重复多次就可以得到单个的纯藻细胞。
96孔板法:96孔板在微藻快速分离筛选方面起到重要作用。目前常用的方法是将待分离的水样进行稀释,直到每滴大概含有一个微藻细胞为止,然后将稀释好的藻液按照每孔一滴加入到含有分离培养基的96孔板中,每孔大概250μl,培养基可以是液体的也可以是固体。置于预先设置好培养条件的人工培养箱中富集培养。如此,在一定的天数之后,某些96孔中所长出来的微藻就有可能是纯种微藻。
卵囊藻怎么培养
卵囊藻一般都是淡水种,可以在驯化后在低盐度海水中使用,千分之十五以下。但是扩种培养需要在淡水进行,一般采用bg11或者se培养基培养,温度在18-25摄氏度,光照周期14:10或者12:12,光照强度3000-6000lux。
光语提供的藻种密度是多少
我们提供的藻种只保证生物活性,可扩培,不承诺高密度生物量,高密度生长指数期的藻种不利于保种和运输,接种后很容易进入衰退期。
购买藻种提供培养微藻培训吗?
客户在光语生物科技有限公司购买藻种,我们会提供一份藻种扩培指引和藻类培养基配方,生长条件以及常见培养遇到的问题处理以及大批量培养的方法等。我们无法提供一对一的零基础培训和指导。如需相关培训请联系提供相关课程的机构,例如中国科学院水生生物研究所,National Center for Marine Algae and Microbiota (NCMA)等单位
一般加速微藻生长的氮源采用哪些成分?
在实验室和发酵工业生产中,我们常常以铵盐、硝酸盐、牛肉膏、蛋白胨、酵母膏、鱼粉、血粉、蝉蛹粉、豆饼粉、花生饼粉作为微生物的氮源。不同的微藻对于有机氮源的代谢机制也不同,所以一般实验都是要先做平行实验看看到底需要哪种有机氮源。如果觉得平行实验分析周期太长,索性 就按照NPM配方加入里面的氮源组分也可培养起来。
培养藻种的海水来源
我们的海水来自乐清湾海水稀释或者溶解粗粒海盐并经过高温高压灭菌。乐清湾水质肥沃,饵料生物丰富,十分利于海水养殖,是浙江省蛏、蚶、牡蛎三大贝类的养殖基地和苗种基地。贝类育苗的首选饵料就是海洋藻类。
你们的藻种保证无菌吗?!
我们的液体藻种不承诺无菌。
我们藻种只保证藻细胞的活性没有杂藻和原生动物,我们的保存环境有空调房和十万级无尘室。所有的操作是在严格的无菌操作台进行。所有藻种的容器和培养基都经过高温高压灭菌
我们的无尘室藻种出厂都会附带一个甲醛或者鲁格氏固定样以便客户观察藻种发出时状态。
但是对于在运输和包装过程出现的细菌污染以及客户的操作无可控制,因此如需完全无菌的藻种请购买我们的藻种固体平板或者自行划线分离。
光语藻种和培养基发货地在哪里
我们的藻种根据淡水藻,海水藻,赤潮藻(严格控制)的不同以及对水质的要求存放在上海、浙江、福建三个地方。
培养基一般在浙江或者福建发出。
雨生红球藻培养液选择
雨生红球藻异养的碳源是什么?
一般小球藻异养发酵采用的是葡萄糖作为碳源,雨生红球藻(haematococcus pluvialis)缺少利用葡萄糖的机制,一般是采用乙酸钠(醋酸钠,sodium acetate)作为碳源
什么是软骨藻酸?
软骨藻酸(Domoic acid),非蛋白氨基酸,是由长链羽状硅藻代谢产生的一种强烈的神经毒性物质,能导致短期记忆功能的长久性损害。
自从1987年加拿大中毒事件后开始被认识。毒性作用机制可能为:通过谷氨酸与内源性神经递质协同,胞内钙离子超载使信号转导紊乱;代谢紊乱使神经元不具有足够的能量维持正常的静息膜电化学梯度。
软骨藻酸
软骨藻酸(Domoic acid,DA)是一种天然神经性氨基酸,从污染贝类中分离、提取获得或拟菱形藻+尿素可以产生大量的软骨藻酸。兴奋性脯氨酸衍生物和神经毒素,是浮游植物代谢的产物,可以在被藻类污染的海洋食物特别是贝类中检测到,其结构与红藻氨酸和谷氨酸相似,是红藻氨酸受体的兴奋剂。主要由某些拟菱形藻属和菱形藻属的海洋硅藻产生,人们食用毒化的贝类,可引起记忆丧失、眩晕、昏迷甚至死亡等症状,根据这种毒素的中毒特征,被命名为记忆丧失性贝毒(Amnesic Shellfish Poisoning,ASP)。
软骨藻酸可以干扰哺乳动物及人的神经信号传递。软骨藻酸可以与谷氨酸神经递质的受体相结合,它的结合效率比谷氨酸高得多。这种结合过程使神经细胞产生错误指令,误认为谷氨酸浓度过剩,而将其排除出去,直到所有的谷氨酸都被消耗完,以致使神经细胞死亡。它的一种结构类似物,海人草酸也是从红藻如Digenea simplex,Palmeria plamata,Centrocetos clvulatum中发现的,但是,它对神经受体的结合力没有软骨藻酸高。由此开发成功了非常灵敏的软骨藻酸测定方法。先将海人草酸进行放射性标记,并使其与神经受体结合。当出现软骨藻酸时,海人草酸就从受体上释放下来,通过测定游离的放射性强度,就可以测定软骨藻酸的浓度。软骨藻酸的基本骨架是谷氨酸,其侧链是单萜,即异戊二烯的二聚体。其基本的生物合成途径是谷氨酸与3,4-二甲基辛二烯-2,6-焦磷酸(Geranyl py-rophosphate)发生环化反应。
软骨藻酸可影响人和动物的消化道、心血管系统、中枢神经系统,它对与内脏功能有关的脑干区域具有兴奋作用,而对与记忆有关的脑区域具有明显的神经毒性作用。此外,也会损害脊髓、视网膜。研究发现,贝组织中软骨藻酸含量达到40mg/kg时可引起食用者中毒,150mg/kg时有致死危险,人类通过进食可耐受的最大限量为20mg/kg,加拿大首先制定了安全限量标准为20μg/g贝肉,欧洲、日本也相继将该种毒素列为贝类常规检测项目。
莱茵衣藻cc3960培养注意事项
cc3960是莱茵衣藻的突变体,在培养的时候除了添加6mmol/L铜离子之外还需要添加精氨酸(Arg)才能成活
关于底栖硅藻培养
硅藻当中底栖类的培养是一个很头疼的问题,由于分泌的胶质物有粘性,藻会黏到一块去,容易产生絮状沉底,摇晃一下好一点,不一会就又全部沉底了,使得生物量很难涨上去。
一般我们建议客户将硅藻上清取出后扩培 ,这里面的细胞大都没有黏在一起,都还是独立个体,在新的培养基里面培养,定期的搅拌,使得整个水体的藻类都分布均匀,产生絮状沉底的现象大大减少。
硅藻生长周期一般是3-4天就要加培养基扩培了,否则产生胶质物的浓度就会将藻粘在一起。
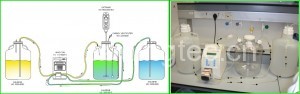
f/2浓缩培养液使用要注意哪些问题
上海光语生物科技有限公司为广大客户提供的f/2浓缩培养液在使用过程中应该注意哪些问题?
培养液的配置需要在超净台上操作,这样子一般不会染菌。只要每次吸取都更换灭过菌的枪头。浓缩液可以加到海水里面高压灭菌,不过有文献说维生素高温会降解,所以一般是维生素灭菌之后添加。如此繁琐 还不如都等使用前添加。当然,如果使用中发现母液有沉淀,一般是要重新抽滤。 除了维生素和硅酸钠需要用一次性注射器和针孔滤膜过滤 其他3种都是先抽滤后高压灭菌。我们多次测试:一般只要使用过程中做到尽量无菌和无外源污染以及枪头交叉污染,至少1年之内不会染菌或者沉淀。
配置海水消毒后按比例添加f/2母液或者按比例添加母液后消毒两种方法我们做过比对,影响不明显。实际上藻株只要有硝酸钠等几种大组分就能培养,但是我们都添加另外几种,至于细胞对微量元素的吸收情况,做针对性研究的不多,大家都是根据细胞内组分推断细胞利用的营养成分。
藻类保存需要添加哪些元素
藻类长期保存是一件很头疼的问题,一般我们添加一些N元素,如尿素,氯化铵等,C元素,碳酸氢钠,二氧化碳等,一些抑菌剂比如磷酸三钾等
“11/5 o’clock direction”是什么意思?
严先生答:
哪些藻会发光
夜光藻(学名:Noctiluca scintillans),俗称海耀[1],也称夜光虫,为一种在海中生存的非寄生甲藻,能作生物发光。这种藻类之所以能发光,是因为其体内数以千计的球状胞器中,具有萤光素-萤光素酶,这些胞器就像微型的电源供应器,让夜光藻在感受到周遭环境的变化时发出萤光。
夜光藻为异养有机体,它能够吞噬,会以浮游生物、硅藻、甲藻、细菌,甚至鱼卵为食,有文献指出,硅藻为夜光藻最爱的食物;它也能以光合作用生存[2]。实验室条件下我们一般都是投喂扁藻。
藻类本身并无毒性,但其吞食浮游生物之后,体内会留下大量的氨,这些氨会被藻类排泄出来至附近水域,有些特殊藻类则能将之转化为神经毒素(例如亚历山大藻),造成该水域中的生物死亡。
夜光藻一般保存期很短就1-2个月,而且只有夏季水温高的时候才能筛选到。
塔玛亚历山大藻是可以发光的,但是他不能像夜光藻那么亮。只有养的很好的时候才会发光!
三角褐指藻和小新月菱形藻的区别
硅藻生活习性方面的知识
源自http://tolweb.org/Diatoms/21810
http://earthobservatory.nasa.gov/Features/Phytoplankton/
Introduction
The diatoms are one of the largest and ecologically most significant groups of organisms on Earth. They are also one of the easiest to recognize, because of their unique cell structure, silicified cell wall and life cycle. They occur almost everywhere that is adequately lit (because most species need light for photosynthesis) and wet – in oceans, lakes and rivers; marshes, fens and bogs; damp moss and rock faces; even on the feathers of some diving birds. Some have been captured by other organisms and live as endosymbionts, e.g. in dinoflagellates and foraminifera. Because of their abundance in marine plankton, especially in nutrient-rich areas of the world’s oceans, diatoms probably account for as much as 20% of global photosynthetic fixation of carbon (~ 20 Pg carbon fixed per year: Mann 1999), which is more than all the world’s tropical rainforests.
 Hydrosera. © David G. Mann. This image comes from the Professor Frank Round Image Archive at the Royal Botanic Garden Edinburgh
Hydrosera. © David G. Mann. This image comes from the Professor Frank Round Image Archive at the Royal Botanic Garden Edinburgh
Diatom cells have regular geometrical shapes. In a mathematical sense, they are always ‘closed generalized cylinders’ and they are usually straight (‘right’) but the cross section of the cylinder can vary from circular to elliptical to spicular to complex lobed shapes like the Hydrosera cell shown above. The shape is maintained faithfully, whatever the environmental conditions, because the cell wall contains a large proportion of hard, brittle silica, which is partially hydrated [(SiO2)m.nH2O] and non-crystalline. Basically, diatoms live in glass boxes. The silica shell of the diatom is called the ‘frustule’ and is made of two halves, each in turn composed of several different pieces. Hydrosera frustules, like those of all other diatoms, are perforated by many small holes, which allow water, dissolved material and solids (gases, inorganic nutrients, and organic substrates and secretions) to pass in or out.
Left: Living diatoms and other algae from a freshwater loch in Scotland. Right: False-colour picture of a subfossil assemblage from a muddy deposit a few metres below the surface of a mire in SW Scotland. © 2008 David G. Mann
The silica of the diatom cell wall is resistant to decay, although it will begin to dissolve once its organic coating has been stripped off. Once incorporated into silica-rich sediments, however, frustules may survive for hundreds to millions of years and can be used to monitor changes in freshwater or marine environments. The left-hand picture above shows a spread of living diatoms and other algae from a freshwater loch in Scotland. Each cell contains one to several brownish chloroplasts. Shown in the right-hand (false-colour) picture is a subfossil assemblage from a muddy deposit a few metres below the surface of a mire in SW Scotland. Here, all the cells are empty – only the cell walls remain; indeed, in many cases the cell walls have fallen apart into their component pieces. But it is still possible to identify them, because the walls retain their shape and pattern. Consequently, if the ecologies of the species are known, then the fossil assemblage can be used to estimate what conditions were like when it was formed. In the assemblage illustrated there are both planktonic species (the circular Cyclotella valves) and benthic species, which have become mixed together after death.
Life cycle series of Navicula reinhardtii valves. © 2008 David G. Mann
Because of the construction of the silica frustule and the way in which cells divide, average cell size declines during the life cycles of most diatoms. The shape often changes too, as in the series of Navicula reinhardtii valves shown. It can take a long time for cells to decline to their smallest size – often several years in nature – but sooner or later there is an abrupt restitution of size, taking a few days, involving formation of a special cell, called an auxospore. This behaviour is unique.
Variation in shape and size during the life cycle causes major problems for people trying to identify diatom species and also for taxonomists, if only a few dead specimens are available for study. If diatoms ‘miss’ the chance to form auxospores (for example, if suitable mates are not available, or if environmental conditions are unsuitable), the cells continue to divide, getting smaller and smaller until they die.
Characteristics
Diatoms share several characteristics with some or all other heterokont algae, including (see also van den Hoek et al. 1995):
- plastids that are enclosed by four membranes. The inner two are homologous with the two membranes surrounding the plastids of Rhodophyta, Chlorophyta and Glaucophyta. The outer two, often referred to as ‘chloroplast endoplasmic reticulum’ reflect the origin of the heterokontophyte plastid as a secondary endosymbiont, related to extant Rhodophyta.
- between the outer and inner chloroplast membranes, there is often a network of anastomosing tubules called the periplastidial reticulum.
- grouping of the thylakoids into stacks of three (lamellae) within the plastid.
- presence of a girdle lamella beneath the plastid membranes, surrounding all the other lamellae.
- chlorophylls a and c and fucoxanthin as the major light-harvesting pigments for photosynthesis.
- chloroplast DNA usually concentrated within a ring-shaped nucleoid at the periphery of the plastid (but there are exceptions in some diatoms!)
- a β-1,3-linked glucan as the main reserve polysaccharide.
- possession of special tripartite stiff hairs (‘mastigonemes’) on a flagellum.
- mitochondrial inner membrane developed into tubular invaginations.
Diatoms share with the bolidophytes a unique 2 amino-acid insertion in the large subunit of Rubisco.
The characteristics of diatoms are that:
- all species are unicellular or colonial coccoid algae. None are free-living flagellates.
- the only flagellate cells produced are the male gametes (= sperm, spermatozoids) of ‘centric’ diatoms. These have a single forward-pointing flagellum, which bears mastigonemes.
- the relative proportions of the chlorophylls and fucoxanthin produce a yellow-brown or greenish-brown colour in the plastids.
- most have a large central vacuole or pair of vacuoles.
- cells (especially during stationary-phase) often accumulate large quantities of lipids and fatty acids; polyphosphate bodies are also present and sometimes take the form of discrete spherical or complex ‘volutin’ granules, one per vacuole.
- secretion of extracellular polymeric material (usually polysaccharides) is common, as stalks, pads, capsules, tubes, chitin fibres, or trail material from locomotion.
- all cells (except the gametes and endosymbiotic diatoms) possess a bipartite cell wall comprising two overlapping halves.
- each half-wall itself consists of a large end-piece, the ‘valve’, and several or many narrow bands or segments, which together form the ‘girdle’.
- the cell wall is almost always heavily silicified.
- cell wall elements (valves, girdle bands, and auxospore scales and bands) are formed intracellularly, in special membrane-bound ‘silica deposition vesicles’ associated very closely with the cell membrane; they are not secreted from the cell until they are complete.
- new wall elements are always produced within the confines of an existing cell wall. As a result, average cell size usually decreases with successive mitotic divisions during the life cycle.
- size is restored via the formation and expansion of a special cell, the auxospore, which is usually a zygote. The basic shape of each diatom species is largely created during the expansion of the auxospore, but is often modified during subsequent mitotic cell divisions.
- during vegetative mitoses, the nucleus always lies to one side of the cell immediately beneath the girdle, at the edge of the hypotheca.
- mitosis is open, the nuclear envelope breaking down before metaphase; the spindle is a narrow cylinder, persistent at telophase, consisting of two interdigitating half-spindles, each associated with a polar plate.
- the chromosomes bunch closely around the cylindrical spindle at metaphase, becoming impossible to separate and count.
- cytokinesis occurs through cleavage.
- the life cycle is strictly diplontic: as far as is known, all vegetative cells of all species are diploid, and all mitoses take place in the diploid phase. However, haploids have occasionally been grown in culture in a few species.
- they occur just about everywhere in aquatic and damp terrestrial habitats, providing that photosynthesis is possible!
- they are amazingly diverse, with hundreds of genera and perhaps 200,000 species (Mann & Droop 1996), of which only a tenth have been described so far.
Relationships of Diatoms to Other Groups
Despite a number of studies to examine phylogeny, using one or several genes, the relationships of diatoms to other groups are still unclear and there is still a huge gap in our understanding of how and when diatoms acquired their unusual morphology and life-cycle characteristics. The diatoms have often been treated as a separate phylum, reflecting their unique features. Pascher (1914, 1921) suggested that the diatoms have features in common with the Chrysophyceae and Xanthophyceae and therefore placed these classes and the Bacillariophyceae in the phylum Chrysophyta. Ultrastructural and molecular sequence data have confirmed the general thrust of Pascher’s idea, placing the diatoms unambiguously among the heterokont protists (‘stramenopiles’) within the chromalveolates (Adl et al. 2005).
In the past, it was sometimes suggested that diatoms evolved well before their appearance in the fossil record and that the early phases in diatom evolution were lost long ago through diagenesis of diatomites to chert (e.g. Round 1981). This is made extremely unlikely by recent molecular phylogenies, which date the origin of diatoms towards the beginning of the Mesozoic Era. Furthermore, a close relationship to other silica scale or silica skeleton-producing algae and protists, such as the Chrysophyceae, is not evident in recent analyses. The closest known relatives of the diatoms are the bolidophytes (Bolidophyceae), which are a small group of marine autotrophic picoplankton with the same kind of plastids and flagellum structure as diatoms and some other autotrophic heterokonts (Guillou et al. 1999). However, bolidophyte cells are highly reduced and simplified and do not seem to produce any silica structures, although it is possible that silicifying life cycle stages have been missed.
Mann and Marchant (1989) suggested that another group, the Parmophyceae, may also be closely related to diatoms and thus may give hints as to how diatoms arose, because they produce silica scales that in some respects (radial pattern subtended by a central ring, space-filling development of pattern) resemble diatom valves and girdle bands. So far, no DNA sequences have been confirmed to be derived from Parmophyceae, but a clade of unknown heterokonts closely related to diatoms and bolidophytes has been detected by Lovejoy et al. (2006) and may represent the Parmophyceae; it is certainly important for understanding the evolution of both bolidophytes and diatoms that the organisms detected by Lovejoy et al. are fully characterized.
Round and Crawford (1981) and Mann and Marchant (1989) developed hypotheses about how the diatom frustule evolved, based on comparative morphology. Both suggested that diatoms probably arose from scaly celled ancestors. The scale-case was thought initially to have been homogeneous (all the scales were fairly alike in size, shape and structure). Then there was a stage in which the scales became differentiated into larger valve-like scales and narrower ones that resembled the segments found in the girdles of modern Rhizosolenia species (though this is not meant to imply that modern rhizosolenids are a basal offshoot), and a still later stage when the proto-girdle bands became even narrower, forming hoops around the cell.
According to this evolutionary progression, valves and girdle bands would have a common origin, which seems reasonable because their structure is often similar and they are formed in similar ways. Furthermore, cells covered evenly with scales are known in diatoms, in the auxospores of some centric diatoms, e.g. Melosira orEllerbeckia (Crawford 1974, Schmid & Crawford 2001).
The main differences between the Round–Crawford and Mann–Marchant hypotheses are in the assumptions made about the nature of the scales and scaly cell in the early (‘Ur’) diatoms and the nature of the scaly cells themselves. In the Mann–Marchant scheme, the scales of the pre-diatom were space-filling structures, which abutted to form the complete, functional cell wall of a temporarily dormant cyst, whereas Round and Crawford envisaged the scales as separate elements that did not abut but were imbricate, covering growing vegetative cells as in modern synurophytes.
No precursors of diatoms have been identified from the fossil record.
Discussion of Phylogenetic Relationships
Just as it is something of a mystery at present as to how and why the diatoms arose from among the other heterokont algae, so also we have little idea about relationships among the major lineages within the diatoms. At the generic level and, to a lesser extent, within families of diatoms, considerable progress has been made during the last 40 years, as a result of huge injections of new information and analysis, first from electron microscopy (particularly scanning electron microscopy), then from examination of cell structure and sexual reproduction – which are characteristics previously ignored by most diatomists – and most recently from molecular phylogenetics. However, these data have not yet provided a clear idea of higher-level relationships in diatoms, among families, orders and classes. Round et al. (1990) described many new genera and resurrected others from obscurity, on the basis of morphological and cytological surveys; these have on the whole been supported by subsequent investigations, including studies based on molecular data. Round et al. also provided a new framework of classes, orders and families to ‘hold’ the revised genera. These have not been so successful. Gene sequence data have shown over and over again that informal analysis of relationships, based on morphology, often fails to reveal the true pattern of evolution. The problem seems to be that parallel or convergent evolution of shape and wall structure has been rampant within the diatoms. But in many cases, molecular analyses have also failed us thus far, partly because of convergent evolution and partly because of analytical difficulties, such as establishing homology in rDNA sequences and hence developing a correct alignment matrix.
Round et al. divided the diatoms into three classes: Coscinodiscophyceae, Fragilariophyceae and Bacillariophyceae, which correspond to three of the main types of valve organization. The Coscinodiscophyceae were to be recognized by having valves in which the pattern of ribs and striae (lines of pores) radiates out from a ring (the annulus). In the Fragilariophyceae, the pattern was feather-like, with the ribs and striae being arranged either side of one or two longitudinal ribs or strips (sterna). And in the Bacillariophyceae, the pattern was similar to that in in the Fragilariophyceae, except that the central strip contained a raphe system. Informally, these three structural variants can be referred to as ‘centrics’ (Coscinodiscophyceae), ‘araphid pennates’ (Fragilariophyceae) and ‘raphid pennates’ (Bacillariophyceae).
Although analyses of molecular sequence data have not yet provided us with a clear picture of the early evolution of the diatoms, one thing has become obvious: the Round et al. three-class system is wrong, if the aim is to reflect phylogeny. The phylogenetic trees that have been published during the last 15 years disagree in many respects, but all show the primary radiation to have occurred among diatoms with a centric valve structure, the pennates having evolved later, from ancestors with centric structure. Furthermore, the Fragilariophyceae are not monophyletic, being paraphyletic with respect to the Bacillariophyceae. So, of the three Round et al. classes, only one – the Bacillariophyceae – is satisfactory.
The main features that appear in several phylogenetic trees (once the topologies of the trees have been simplified to include only those relationships that have good statistical support) are:
- a basal polytomy of clades, all but one of which have circular valves (very rare exceptions) with a centric valve pattern and monopolar or radial symmetry; the clades with circular valves and centric organization are often referred to as the ‘radial centrics’. The ‘radial centrics’ may be a monophyletic group and appear so in some published trees; on the whole, however, it appears that they are not.
- a further clade in the basal polytomy that comprises the remainder of the centric diatoms and all of the pennate diatoms. The centric diatoms in this clade usually have a polar organization. The pattern still radiates from an annulus, but the valves are usually elliptical or elongate, triangular or triradiate, etc, and the structure of the valve shows bi- to multipolar symmetry; circular valves are uncommon and possible secondarily derived. Centric diatoms of this kind are often referred to as ‘polar centrics’.
- the polar centrics rarely appear in molecular phylogenies as a monophyletic group; instead, they are usually paraphyletic with respect to the pennate diatoms.
- the pennate diatoms are monophyletic.
Medlin & Kaczmarska (2004) proposed a replacement for the Round et al. scheme, based on interpretations of molecular and some nonmolecular data, in which the diatoms were divided into two subphyla, Coscinodiscophytina (= ‘radial centrics’) and Bacillariophytina (‘polar centrics’ + pennates), and the Bacillariophytina in turn into two classes, the Mediophyceae (‘polar centrics’) and Bacillariophyceae (pennates). Note that Medlin & Kaczmarska’s use of ‘Bacillariophyceae’ (all pennate diatoms) differs from that of Round et al (1990) (only raphid pennate diatoms). It is very likely that the Mediophyceae are paraphyletic and quite likely that the Coscinodiscophytina are also paraphyletic. Because of this, and because some published molecular analyses are said not to be repeatable, the Medlin–Kaczmarska scheme has been heavily criticized (e.g. Williams & Kociolek 2007). However, the new classification does have the virtue, relative to the Round et al. (1990) classification, that it reflects better the finding, now generally agreed and consistent with the fossil record, that diversification occurred first among diatoms with a centric valve structure, and that pennates evolved later from within one out of several or many centric clades. Although this is not a new idea (e.g. Simonsen 1979), it was only one of many possibilities aired before the advent of molecular systematics (see Mann & Evans 2007).
Adl et al. (2005) adopted Medlin & Kaczmarska’s names but noted that the Coscinodiscophytina and Mediophyceae might be paraphyletic. Here, Medlin & Kaczmarska’s formal taxa are used only where there seems to be good support for monophyly (i.e. the Bacillariophytina and Bacillariophyceae). Nevertheless, it is often useful to distinguish Medlin & Kaczmarska’s Coscinodiscophytina and Mediophyceae informally, as ‘radial centric diatoms’ and ‘polar centric diatoms’, to highlight what seems to be a well-established feature of diatom evolution, that complex shapes and bi- or multipolar structure developed in one clade of centric diatoms (within which the pennates evolved later), but not in several others.
Global Significance
It has been known for a long time that diatoms are abundant in aquatic habitats, forming an essential part of many food chains. However, it was not until the 1990s that their huge contribution to the global carbon economy began to be fully appreciated. A back-of-the-envelope calculation (Mann 1999) goes like this:
- total net primary production for the globe is ~ 105 Pg carbon per year (Field et al. 1998)
- of this, about 46% occurs in the oceans and 54% on land (Field et al. 1998)
- of the oceanic component, about one-quarter (11 Pg) takes place in oligotrophic (nutrient-poor) regions, one-quarter (9.1 Pg) in eutrophic (nutrient-rich) regions, and half (27.4 Pg) in the remaining mesotrophic regions (Field et al. 1998)
- diatoms account for no more than 25-30% of primary production in nutrient-poor waters, but perhaps 75% in nutrient-rich regions (Nelson et al. 1995); so, assume an intermediate value of 50% for mesotrophic waters
- the total contribution made by diatoms is then {(11 × 0.25) + (27.4 × 0.5) + (9.1 × 0.75)} = 23.275 Pg carbon per year, which is ~ 23.5% of the global total
It’s probably an overestimate, but the importance of diatoms is evident nonetheless. For comparison, all the world’s tropical rainforests fix 17.8 Pg, all the savannas 16.8 Pg, and all the world’s cultivated area another 8 Pg. The fate of the carbon that diatoms fix is now a crucial issue in climate-change research.
Another way to appreciate diatoms is to realize that they give us every fifth breath, by the oxygen they liberate during photosynthesis.
General Texts
Round, F.E., Crawford, R.M. & Mann, D.G. (1990). The diatoms. Biology and morphology of the genera. Cambridge University Press, Cambridge. 747 pp.
Stoermer, E.F. & Smol, J.P. (1999). The diatoms. Applications for the environmental and earth sciences. Cambridge University Press, Cambridge. 488 pp.
van den Hoek, C., Mann, D.G., Jahns, H.M. (1995). Algae. An introduction to phycology. Cambridge University Press, Cambridge.
References
Adl, S.M., Simpson, A.G.B., Farmer, M.A., Andersen, R.A., Anderson, R.A., Barta, J., Bowser, S., Brugerolle, G., Fensome, R., Fredericq, S., James, T.Y., Karpov, S., Kugrens, P., Krug, J., Lane, C., Lewis, L.A., Lodge, J., Lynn, D.H., Mann, D.G., McCourt, R.M., Mendoza, L., Moestrup, Ø., Mozeley-Standridge, S.E., Nerad, T.A., Sheraer, C., Spiegel, F. & Taylor, F.J.R. (Max) (2005). The new higher level classification of eukaryotes and taxonomy of protists. Journal of Eukaryotic Microbiology 52: 399-451.
Field, C.B., Behrenfeld, M.J., Randerson, J.T. & Falkowski, P. (1998). Primary production of the biosphere: integrating terrestrial and oceanic components. Science 281: 237-240.
Crawford, R.M. (1974). The auxospore wall of the marine diatom Melosira nummuloides (Dillw.) C. Ag. and related species. British Phycological Journal 9: 9–20.
Guillou, L., Chrétiennot-Dinet, M.-J., Medlin, L. K., Claustre, H., Loiseaux-de Goër, S., Vaulot, D.: Bolidomonas: a new genus with two species belonging to a new algal class, the Bolidophyceae (Heterokonta). Journal of Phycology 35, 368–381 (1999).
Lovejoy, C., Massana, R. & Pedrós-Alió, C. (2006). Diversity and distribution of marine microbial eukaryotes in the Arctic Ocean and adjacent seas. Applied and Environmental Microbiology 72: 3085–3095.
Mann, D.G. (1999). The species concept in diatoms. Phycologia 38: 437-495.
Mann, D.G. & Droop, S.J.M. (1996). Biodiversity, biogeography and conservation of diatoms. Hydrobiologia 336: 19–32.
Mann, D.G. & Evans, K.M. (2007). Molecular genetics and the neglected art of diatomics. In: Unravelling the algae – the past, present and future of algal systematics (Ed. by J. Brodie & J. Lewis), pp. 231-265. CRC Press, Boca Raton, Florida.
Mann, D.G. & Marchant, H. (1989). The origins of the diatom and its life cycle. In J. C. Green, B. S. C. Leadbeater & W. L. Diver (eds.) The chromophyte algae: problems and perspectives (Systematics Association Special Volume 38), pp. 305–321. Clarendon Press, Oxford.
Medlin, L.K. & Kaczmarska, I. (2004). Evolution of the diatoms: V. Morphological and cytological support for the major clades and a taxonomic revision. Phycologia 43: 245–270.
Nelson, D.M., Tréguer, P., Brzezinski, M.A., Leynaert, A. & Quéguiner, B. (1995). Production and dissolution of biogenic silica in the ocean: revised global estimates, comparison with regional data and relationship to biogenic sedimentation. Global Biochemical Cycles 9: 359-372.
Pascher, A. (1914). Über Flagellaten und Algen. Berichte der Deutschen Botanischen Gesellschaft 32: 136–160.
Pascher, A. (1921). Über die Übereinstimmung zwischen den Diatomeen Heterokonten und Chrysomonaden. Berichte der Deutschen Botanischen Gesellschaft 39: 236–248.
Round, F.E. & Crawford, R.M. (1981). The lines of evolution of the Bacillariophyta. I. Origin. Proceedings of the Royal Society of London, B 211: 237–260.
Schmid, A.-M.M. & Crawford, R.M. (2001). Ellerbeckia arenaria (Bacillariophyceae): formation of auxospores and initial cells. European Journal of Phycology 36: 307–320.
Simonsen, R. (1979). The diatom system: ideas on phylogeny. Bacillaria 2: 9–71.
Williams, D.M. & Kociolek, J.P. (2007). Pursuit of a natural classification of diatoms: history, monophyly and the rejection of paraphyletic taxa. European Journal of Phycology 42: 313-319.
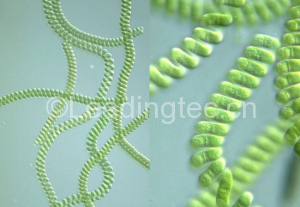
如何判断中肋骨条藻的状态
由于中肋骨条藻的实验室培养比较困难,1.5年左右就会衰退,需要重新在海域采集,因此很多客户在实验室判断中肋骨条藻的状态就遇到困惑。
中肋骨条藻状态好的话,细胞一个一个的很饱满,连成10~30个每条链,由于没有鞭毛,它不会动的。
什么藻可以超低温保存
超低温保存只适合于部分硅藻和蓝藻,并不是所有藻都合适,有鞭毛的藻也不能进行超低温保种,即使保种成功了,成活和复壮率很低的,只有不到10%左右。成活的从低温取出到完全复壮也要3个月时间。
请问东海原甲藻是无色的吗?密度大的时候会产生颜色吗?
有颜色 密度低时没有 高时是棕黄色 密度最好可以到10 的6次每毫升。
培养夜光藻的方法
培养夜光藻的关键并不是培养基的配方而是在于混养,夜光藻需要吃藻才能生长良好,一般可以考虑混养扁藻
藻类如何破壁
藻类细胞破壁技术作为一种高科技手段,其应用十分广泛。除病毒外,一切生物均由细胞构成,根据细胞内核结构分化程度的不同,细胞可以分为原核细胞和真核细胞两大类型。细胞壁(cellwall)是细胞的外层,在细胞膜的外面,细胞壁之厚薄常因组织、功能不同而异。植物、真菌、藻类和原核生物都具有细胞壁,而动物细胞不具有细胞壁。细胞壁本身结构疏松,外界可通过细胞壁进入细胞中。
藻类的细胞破壁最有效的方法就是采用液氮研磨
液氮研磨在分子生物学实验中应用广泛,特别是有关核糖核酸(RNA)、脱氧核糖核酸(DNA)的分离。液氮的温度为一196℃,它既能使各种组织成分不易被破坏或降解,又能使组织变硬,脆性增加易于磨碎。正是由于液氮的温度极低,操作时要特别小心。液氮研磨,一是为了终止细胞内外一切生物反应,比如提取RNA时,防止RNA酶的降解反应等;还有一个原因,就是在液氮中的细胞完全冻硬了,研磨可以达到很好的破胞效果,将细胞磨成粉,使里边的物质释放出来。
当前小球藻成品市场的相关价格及使用方法?
2012年年底开始,小球藻成品开始在市场上销售。5kg罐装的销售价格可咨询当地经销商,适用于5~8亩。
首先,因为小球藻是一个活体的藻种,生产出来之后必须在0℃~4℃低温保存,但也不能结冰,因为结冰后小球藻细胞壁会破壁,膨胀后就会坏死,0℃~4℃度范围内可以确保小球藻的种质完好。由于是高浓缩的藻种,小球藻的保质期不长,在低温状态下能保存3个月左右。
所以,小球藻的使用方法是先从冰箱里取出来,放入大桶,不需要加水,让其自然升温。等小球藻的浓缩液和周围气温差不多的时候,在放入桶内,倒入小球藻加水加培养基后让其曝气活化,24h左右后下塘再使用,效果非常理想。
海水种小球藻保存的适宜温度是多少?
海水小球藻的适宜生长温度其实和淡水藻种差不多,在南方适应性可能会更好一点,尤其是湛江、海南等接近热带地区的省份,常年的温度都在25℃~35℃,非常适合小球藻的生长,20℃以下低温的生长条件就不太理想。
异养发酵小球藻浓缩液有几种类型
根据用途不同,我们公司的异养发酵小球藻浓缩液可以分为肥水和投喂两种用途,肥水的小球藻浓缩液浓度是每升干物质在60-70g,投喂的小球藻浓缩液浓度是每升干物质90-100g。
投喂的小球藻浓缩液可以根据投喂对象的不同配比营养物组成,控制蛋白质,脂肪的比例。
肥水小球藻浓缩液适用于全国大部分地区的水质,但是建议客户在大批量购买前,先购买少量试验一下。
如需使用小球藻干粉请不要选择购买浓缩液然后干燥的方式,直接购买我们的小球藻粉性价比更高。
怎样鉴别小球藻真假?从产品包装外型上能否区别真假藻种?
小球藻首先要生存在水体中,鉴别小球藻的真假主要是看它的储存方式。如果有宣传说小球藻方便简单易用,而且不需要低温保存来抑制小球藻的活性,那么这种小球藻产品十有八九是假货。同时不能是干燥的,必须是液体保存。而且我们的小球藻浓缩液是通过专利技术高密度保存,即使是低温保存,保质期也不超过3个月。所以,市面上宣传常温条件下能保存1年并且能随时使用的小球藻产品也是假冒的。
从产品包装外型上区分不了藻种真假。满足低温保存条件,就说明该藻种50%是真的。剩下一半的真假性就需要把藻种放到显微镜下检测来确定。
清除藻类培养瓶上白色物质
有谁知道藻类培养过后,培养瓶上留下来的一层白色物质是什么?有什么办法在洗瓶子的时候把它清理干净?我看那个放培养液的瓶子里也会残留一点,但是没有培养藻液瓶子里的留得多
答:这些白色物质一般是盐沉淀,用稀盐酸或者高锰酸钾泡
螺旋藻有哪些真实准确的作用
市面上常见的螺旋藻突出它的保健效果,我们没有此领域的补充,主要是从螺旋藻营养组成角度分析螺旋藻的作用。
WHO于2008年公布的《6个月到5岁中度营养不良儿童的食物与营养成分选择》对于螺旋藻的推荐意见:“有些研究显示螺旋藻对于改善儿童中度营养不良可能有一定帮助。”因此联合国有个计划就是在非洲粮食短缺地区推广螺旋藻以解决粮食危机IIMSAM Sustainable Spirulina Outreach Program .:. Sustainable Development Knowledge Platform
根据对螺旋藻的成分分析,螺旋藻蛋白质含量的确很高,但仅限于和一般蔬菜相比。牛奶鸡蛋的蛋白质含量不但更高,还更优质.某些地方有螺旋藻锅底的火锅,据说味道不错。
FAO在1974年说过螺旋藻是“未来最佳食品”,可FAO这个定义也明确指出:只有在特定情况下,即粮食极度缺乏,资源匮乏,螺旋藻才可以作为一种投入产出比较高的作物暂时替代常规食品。这一点在2008年FAO发布一份报告也有体现。
这份报告推荐的螺旋藻开发方向是:解决贫困地区的营养问题;废水处理;代替部分家禽、牲畜以及渔业养殖的饲料以降低生产成本;在紧急状况下暂时解决粮食问题。
“暂时解决粮食问题”完全是一种应急措施,只有在遭受地震、洪水或者其他自然灾害之后,常规粮食难以生产行的情况下,才可以生产螺旋藻来充饥。
NASA和欧航局在上世纪80年代将螺旋藻作为宇航员长期太空生存的推荐食物的原因,也是源自空间站的空间限制。因此在特殊年代和背景下,FAO以及IIMSAM等国际组织对于螺旋藻的积极态度,也都只是着眼于它有助于解决粮食短缺问题而已。
螺旋藻主要的营养成分是藻蓝蛋白,其他的都次要,国内有实验室以前做过将藻蓝蛋白与癌细胞融合,结果使得癌细胞弱化了不少,当然这个可能不能直接证明抗癌作用。
在韩国78名60岁以上老年人中进行的:连续16周、每天服用8克的螺旋藻补充剂的受试者比服用安慰剂者,其胆固醇水平降低,一些免疫系统功能指标亦有提升。螺旋藻就是蛋白质含量高(高于60%)而已,最大的功效就是可以作为日常摄入营养替代品。
小球藻需要在0℃~4℃保存,夏天可以放在温度比较低的土窑或者深井保存吗?
如果北方土窖的温度高于4℃,保存时间会非常短。因为高于4℃,小球藻很活跃,2~3d就会发黑发臭然后死亡。如果高于4℃,最好是在1~2d之内全部使用。
小球藻有什么优势和劣势?
暂时来说,因为许多的藻类都会倒藻,倒藻就会产生毒素,而小球藻作为一个小型绿藻,基本不会产生毒素。作为一种优势藻种,它具有几大优点:首先,溶氧充足;其次,亚硝酸盐,氨氮的指标很低;第三、pH值非常稳定;第四,生长稳定,存活周期长。目前来说,小球藻唯一的美中不足就是pH值在培育前几天会出现0.1~0.2的波动,而且要天气晴朗时使用最好。
带鞭毛藻的大规模培养如何选择泵
在我们大规模培养藻的时候一般的管道泵是可以胜任循环工作的。可是在培养带鞭毛的红球藻和衣藻等带鞭毛的藻的时候,告诉旋转的叶轮对于这些藻来说是相当有杀伤力的。
因此在大规模培养带鞭毛藻类的时候我们一般建议客户在以下几种泵根据具体情况选择:
正弦泵、蠕动泵、隔膜泵、平叶泵
如果藻类过滤在滤膜上,保存在液氮里,它还活着吗?可不可以拿出来培养一下呢
一般保存到液氮要用dmso(二甲基亚砜)或或者甘油作为保护剂,如果没有加保护剂可以碰碰运气用水浴迅速解冻,有可能有极少的活细胞 。
怎么培养雨生红球藻
雨生红球藻的培养温度要设在23±1度,营养细胞培养阶段的光强设为1300-1600lx,促进虾青素积累的胁迫阶段光强10000-12000lx,静止培养的话每天手摇3-4次,防止粘壁。管道培养需设计相应结构。
EDTA缓冲液的配备技巧
EDTA的溶解度小,用纯水加热溶解也不是很多,一般都配成钠盐的溶解液,按照分子量配比。
或者配备EDTA溶解液的时候用NaOH助溶,加一点然后让它溶一会儿,不行继续。最终在培养液里面EDTA的用量很少,不会影响整体的pH值
怎么过滤死藻
螺旋藻只能用捞金鱼的400目的网,捞上层的活藻,其他的个体小的藻还是用滤纸过滤吧
至于其他藻类很难区分死藻活藻了,不过一般手动摇过之后一段时间内活藻是悬浮于液体中的,死藻则沉降,可以将悬浮液转到干净的瓶子中离心收获活藻
为什么你们的小球藻浓度没有别人的高,价格却比别人的贵
为什么其他每毫升200-300亿的小球藻浓缩液才十几块到二十几块一公斤,而你们的才100亿卖得还比他们贵呢?
市面上的小球藻浓缩液分为自养和异养稀释2种。
一般产品的小球藻浓度每毫升200-300亿是包括细菌的数量,自养小球藻纯度做到5亿已经是极限了,而且保存时间很短。
我们的小球藻是发酵异养,高纯度,没有任何杂质,我们的每毫升100亿是实打实的小球藻细胞。营养配比可以根据需要改变。高浓度情况下可以长时间保存。
异养稀释的小球藻浓缩液基本上以我们公司的小球藻浓缩液原液为基础进行稀释10倍投放市场,所以价格是我们公司价格的1/10才是正常的。
三角褐指藻三角长不出来退化处理
很多三角褐指藻实验室培养到后来就退化了,三角长不出来了,在这种情况因环境而发生的,一般建议客户增加营养盐浓度 增加光照会慢慢好起来
什么是小球藻浓缩液
小球藻是一种圆形的大小2-10微米的单细胞绿藻类,含有优质蛋白质60%以上,碳水化合物20%,叶绿素5%,大量的矿物质,维生素和生物活性物质。浓缩小球藻培是浮游动物和初期鱼苗的最佳饵料。
浓缩活体小球藻,是采用无菌发酵的方式生产,可以放心使用。常年稳定供应,运送迅速。完全解除了水产养殖育苗生产中饵料生物供应的后顾之忧。
本产品纯小球藻,是针对贝类养殖、鱼虾育苗、轮虫培养等水生动物营养均衡的需要而设置的定向培养。
产品成分: 小球藻浓缩液每毫升将近200亿个细胞。
产品特点:
·使用方便,随泡随用,一年四季使用不受气候影响。
·新鲜活力,营养均衡。
·成本低廉,本产品每升可培养3—5亿轮虫,相当于养殖户培养10吨藻水。
·节省开支,降低风险,避免养殖户因受气候或其它因素影响,藻水密度稀或培养失败而造成的一切费用和时间的浪费。
用法用量: 根据培养密度随机增减投喂量
储藏方法: 放置在阴凉干燥处,避免阳光直射
保质期限: 冷藏3个月
哪个牌子小球藻好
不管哪个品牌的小球藻片,小球藻粉,小球藻饮料制品,小球藻添加剂,上海光语生物科技有限公司的工程师都建议采用纯发酵 的小球藻原粉作为原料,才是最好最可靠的小球藻产品。
小球藻粉的发酵工艺和浓缩小球藻液的工艺完全不同,并非简单使用浓缩小球藻干燥获得,两者采用的是完全不同的国际顶尖工艺,避免了传统的光养开放式培养过程中小球藻吸收了环境中的重金属以及其他有害物质,是最优质的小球藻保健药品、食品、饮料的原材料。
小球藻由于具有纯天然、非提纯、均衡含有人体所需的全面营养素和独特的绿藻生长因子(CGF)、最高的叶绿素含量和碱性生成量,以及独有的排毒功能等显著品质,而成为最科学、最合理、最可靠和最有效的纯植物健康补助食品。
上海光语生物科技有限公司小球藻粉所采用的生产工艺经过多年的技术沉淀,伴随着现代生物科技的发展更成就了其产品的至臻至纯。产品因行销日本,欧美等世界各地而著名并备受用户信赖。
上海光语生物科技有限公司小球藻粉发酵工艺选择优质纯种的蛋白核小球藻,在经过洁净化处理的淡水及充足阳光的照射和清新空气的天然环境中,用先进的质量控制及养殖技术进行培育,再经过纯化发酵工艺和独有的破壁技术处理,以领先的生物加工工艺和严格的品质检验精制成高纯度,高吸收率,高活性,富含人体所需均衡营养素的高品质小球藻粉。
100%小球藻,不添加任何添加剂,并非一般产品可做得到。
世界技术最先进的小球藻发酵异养工艺,专业的生产厂商,营养按需定制
最高的C.G.F.(小球藻生长因子)含量!
味道是浓纯正的水藻香味,但不腥臭
颜色浓绿色,表面均匀,没有杂质(斑点)感,表面柔润
浓缩小球藻液如何肥水
每年开春在投喂鱼苗虾苗蟹苗之前基本都要进行肥水,让水里有更多的浮游动物,我们一般建议客户使用藻类浓缩液进行肥水,传统的自养藻基本只能保存5-7天。肥水用的浓缩藻液甚至一个活藻都没有,而仅仅是一些藻类培养基。
上海光语生物科技有限公司推出的小球藻水质改良剂,富含活体异养小球藻,常温保存在10-13天左右,而且活性极高。我们的小球藻液有效活性物浓度是60-70g/L,相当于纯小球藻细胞60-70亿/ml。客户使用一般的泼洒密度在按照10-50万活体细胞/ml,请按照水体营养情况以及水体容积换算。自然水体小球藻的生存极限密度是500-1000万细胞/ml(换算成干物质0.05-0.1g/L)。
投喂浓度过高会导致水体营养物无法满足藻类生长需要造成活藻缺少营养发黄死亡。
注意,我们的小球藻细胞浓度指的是纯小球藻活性物,不包含细菌数量。市面上的很多产品的细胞密度是包括细菌数量的,因此我们公司一般以藻液有效活性物浓度为标准即每升多少克干物质。
藻种低温保存
在春节长假期间,很多单位实验室放假,藻种的保存首选就是超低温保存。
本方法适合于中、长期藻种保藏,保藏时间一般为2-4年左右。
(1)用火焰灭菌的接种环取斜面藻种在平皿上划线分离单藻菌落。
(2)平皿倒置于30℃或37℃恒温培养箱,培养24-48小时,至单藻菌落的大小为3mm左右。
(3)挑取一个单藻菌落,接种于一个装50mL的300mL三角瓶中30℃或37℃振荡培养10-15小时,至藻密度OD600为1.0-1.5。
(4)用火焰灭菌的接种环取少量种子液,涂片后,作革兰氏染色,在显微镜下观察藻体的形态,及是否有杂藻。
(5)按30%甘油:种子液为1:1(V/V)的量加入无菌甘油, 混合后分装至事先灭菌的藻种保存管(1-2mL/管),-70℃或液氮保存。
用该法保藏过的藻种,如何活化?
保种的藻先接种在培养液里活化好;配置50%的甘油溶液,灭菌;1:1加入,直接放入-80度;复苏的时候,冰上融化,直接接入培养液中。
藻种管由传统的玻璃藻种管改为0.5ml带盖塑料离心管。
该改良法优点有:
⑴操作过程大大简化,藻种管口不需溶封,不抽真空。
⑵藻种管抗破损性极佳;
⑶藻种管体积超小。
⑷成本低廉,易于商品化生产、推广。
实验室藻类培养避免污染注意事项
来自网友颖子:
如果大家是做开放式反应器培养的,污染会有,这也是它相对于密闭式培养的一个弊端,也会受季节影响。不过,如果是2L(甚至更大一些体积),我的理解还是属于实验室培养的,这样避免污染相对简单:传代时培养基应该是除菌的,通气时气体应该在气路上添加滤膜过滤一下,以保证气体的除菌。这样的培养我其实也发现过藻生长状态有时也会和季节相关,虽然在培养箱中理论上不应该影响。不过,这个影响应该不是太明显。
另外,这种摇瓶培养也会因为操作不严格,尤其是一次管理多种藻,传代同时进行等等时发生杂藻的污染,这就得从操作上更严格的克服,比如如果能用大容量移液器添加新鲜培养液,就尽量避免直接的倾倒,否则藻溅起来的飞沫很容易无意中进入培养基中,这样你再传代另一种藻就很容易污染.觉得移液器效率差,要不就专瓶专用吧,总之,得格外小心。
藻种生长退化的处理
网友颖子:关于藻种生长退化的问题我们培养过程中我们遇到过,有时是未及时传代,污染甚至是莫名的原因都有可能。我的建议是如果能得到有其他保留的种,最好借一些重新再养,因为以往经验虽然在提供好的最优化条件继续养有恢复的可能,但真的基本上状态都很难再恢复,不如放弃重新去一些再养。尤其是有污染的藻种,更加麻烦。如果很精贵,无法再取得,那你就先再养养试试,不一定频繁传代就好。静养先看看。有污染的话,不行固体培养筛一下,就是比较费时。
藻类生长使pH升高的原因
培养基制备基本方法
制备基本方法
培养基配方的选定
.培养基的制备记录
培养基成分的称取
培养基各成份的混合和溶化
培养pH 的初步调整
使用操作问题
污水处理采用菌藻共生的方案选择细菌有什么原则?
要根据使用环境来判断,如果是沼液自身产生的都是厌氧菌,对于微藻耗氧环境就不能协同发挥作用,可以考虑在曝气池中的活性污泥耗氧菌来协同生长。同理推断其他的环境和针对藻细胞的特点来选择高活性的菌种来发挥生物多样性的功效。
如何减少培藻过程纤毛虫污染
培藻过程出现的纤毛虫污染,新大泽肖博士建议,避光静置8小时,喷雾器在表面喷洒醋酸就死了.
培藻车间的防污染配置
微藻培养的车间需要设置一定的防污染净化装置来控制空气和水中的竞争微生物,减少有害细菌进入培藻水体的几率。
培藻用水要过滤灭菌,采用强氧化剂(次氯酸、盐酸、臭氧、紫外),在使用前用还原剂(大苏打)去除强氧化剂的残留。
培藻的培养基要彻底的灭菌杀毒,可以采用臭氧或者紫外或者煮开。
培藻的车间需要穿雨鞋,进车间前门口配置5000-10000ppm的碘液来浸泡雨鞋,手上要用酒精或者臭氧喷洒。车间按照合适的位置要配置紫外灯杀灭环境中的微生物(同时避免对藻的伤害),对于气源要过滤并且在气泵房设置紫外灯保证细菌不要进入曝气管路。
如何避免大规模藻类生产中一些不利情况
网友回复:藻类培养中及时传代复壮有助于将藻细胞变形及基质浓缩,增生,胞质色素沉着,细胞数量减少,网状空泡(水泡),聚缩藻团等不良现象减少,提高培藻效果
藻类生产过程中造成藻类状态不好的因素有哪些
1、搅拌或通气等过猛,藻细胞破裂,蛋白溶出;
2、光强度太小或太大,藻细胞自溶;
3、培养液盐度(渗透压)不合适,藻细胞破裂;
4、其有毒有害物包括试剂品质不合格。
仅供参考。
养虾过程如何添加螺旋藻粉
螺旋藻要过100目筛揉洗于水中投喂。按照虾苗数量分次投,大约是每立方米水体1克左右粉。要技术员观察苗的食用效果。(注意残饵量。从溞状(1–6期),糠虾期喂最佳。注意残饵对水质的影响。
18s测序藻细胞需要多少
一般建议客户取100微升,十几个细胞就可以,多了几百个会使得胞内菌对测序结果产生影响。
如何控制微藻培养过程中的虫污染
1、添加400-800ppm的NH4HCO3;
2、添加CO2,控制pH在5.8-6.0;
3、添加5至10ppm的铜离子(Cu2+);
4、往水体加入20kHz的电磁波
如何制作硅藻胶
硅藻的样品不能简单使用甲醛或者其他试剂固定,时间久了色素退化或者硅质壳被化学分解掉,在做硅藻样品固定封片的时候,最后关键一步是点一点硅藻胶(Naphrax)封片,这里的硅藻胶如果直接购买100ml大概需要7-8千人民币。自己制作的话就是购买加拿大树脂和二甲苯色谱纯等体积混合浸泡直至溶解。(加拿大树脂可以用Cargille公司制造的 Meltmount系列产品封固胶 Meltmount 1.680代替)
比较环保的杀菌杀藻产品有哪些?
研究了碘伏和异噻唑啉酮除藻剂对球形棕囊藻赤潮生物的灭杀和控制作用.结果表明,单独使用时,碘伏的最低 有效浓度为30mg*L-1,异噻唑啉酮最低有效浓度为0.30mg*L-1.当两者复配时有协同作用,可提高它们的杀藻能力.碘伏与异噻唑啉酮浓度比为 1.0∶0.15时除藻效果最佳.
还有木醋液配合苦楝素、印楝素、苦栋素、苦豆碱、赖素、烟碱、苍耳水杀藻效果也很好而且环保。
还有常见的辣椒素用量很少效果极佳。
藻蓝蛋白和叶绿素的检测方法是什么?
一般藻粉里面藻蓝蛋白和叶绿素的检测方法是采用SNT1113-2002《进出口螺旋藻中藻蓝蛋白、叶绿素含量的测定方法》
如何进行微藻基因测序鉴定?
请问鉴定微藻是否可以通过18S测序鉴定,有无通用的引物?
微藻分子测序鉴定没有公认的条形码,一般常用的是18s,rbcL和ITS基因,分子鉴定前最好先用形态学大致鉴定一下,确定目和科,能确定属最好,然后去NCBI看看哪种分子标记数据多,然后选择该标记,一般选两种,例如常用的18S和rbcL,经营比对鉴定,但是18S和rbcL还是比较保守,只能在种水平以上适合,如果种内不同株的鉴定比较困难,18s通用引物有的,查文献可以,一般的藻类鉴定文献都有详细介绍方法。
如何保持藻类培养过程培养液pH的稳定
一般培养过程中藻类的生长会导致pH升高,为了长期培养我们需要在培养液配方里面加入一些缓冲剂来保证pH的稳定。一般的培养基配方都是经过优化的,如果选择包含tris成分的培养基,培养过程pH变化比一般不加tris的要稳定很多。比如TAP、ESM、K-medium等等。
注:tris=三羟甲基氨基甲烷
没有高压灭菌锅,怎么才能做到无菌消毒
可以购买现成的光语生物无菌培养基。你只需要准备无菌培养容器,移液管,和其他和藻类培养直接接触的物品。你也可以用微波消毒设备和配制好的培养基。微波杀菌方式可在网上查询
在使用光语培养基之前要高温高压灭菌吗
光语的培养基在出厂经过2次灭菌和滤膜过滤。如果您 收到货后开启过一次保存一段时间再使用,建议您需要再次高温高压灭菌或者滤膜过滤也可以。如果是高温高压灭菌,你会失去一个轻微的液体量,从而增加比例的成分比例。氨会蒸发从而降低氨浓度。维生素应冷藏,维生素如果高温高压会使得成分失效,建议用滤膜过滤
光语的海水如何过滤
我们有最先进的海水过滤系统, 从相邻的海湾提取海水. 经过三层PP棉净水过滤到一吨的桶里面; 把海水运输到实验室. 然后通过一个三级滤芯超滤过滤系统,经过1微米的滤孔后使用。
海水藻的培养水体盐度是多少
光语生物的藻种一般保种采用千分之30的盐度的海水,也有部分低盐度的会特别标注,默认都是千分之30.
养殖水体如何控制蓝藻?
蓝藻爆发对养殖水体的破坏是非常巨大,蓝藻分泌的毒素会导致全部养殖品种死亡,损失巨大,到了蓝藻泛滥的后期再去用药都是得不偿失的,而且所谓的药物治理蓝藻成功都是概率性事件。
前期的控制尤为重要,我们一般分析蓝藻爆发是由于向水体投放了大量的饲料使得水体富营养化,同时高温,这个时候所有的藻类包括饵料藻以及蓝藻都迅速生长处于一个平衡状态;
由于藻类进行光合作用迅速,使得水体中的含氧量升高,而二氧化碳含量降低,pH逐渐升高,而蓝藻相对于饵料藻更适应高pH的水体环境,这个时候蓝藻生长速度快于饵料藻;
饵料藻生长环境收到抑制,同时被浮游动物和养殖品种作为食物消化掉,而蓝藻消化不掉,使得蓝藻占比越来越高。
最终蓝藻死亡分泌毒素造成严重的经济损失。
前期的控制要按照如下步骤:
1、饲料投放严格按照少量多次的原则 ,避免水体富营养化。
2、在藻类旺盛生长的时候也要往水体爆气,增加水体二氧化碳含量或者其他增加水体碳源的物质。
3、及时向水体补充饵料藻,例如小球藻等增加生物竞争,使得蓝藻无法成为优势种群。
4、检测水体的pH变化及时采取措施
离心机可以控制细菌吗?
微藻培养会遇到很多细菌,因为细菌个体小,所以在12000rpm转速的情况下,可以把微藻离心出来,而离心力对细菌不够,细菌会随着清水流走,这种方法可以洗掉大部分的细菌。
微藻破壁技术有哪些
目前用到的破壁技术有高压均质、超临界水处理、脉冲电场等方法
蓝藻中能够提炼出杀灭蓝藻的无公害药物吗?
蓝藻里估计不会,但是有金藻里产藻类生长抑制化合物的报道
为什么培养初期不能给藻类提供24小时持续强光照
在藻类培养初期,一般要求客户使用14:10或者12:12的光照周期,或者是20:4的光照周期而不提倡24小时的持续光照,这里面的原因是什么呢?
根据我们在刚接种的时候微藻浓度较低的情况下,强光照持续实验的结果,光照顶多能增加微藻淀粉、多糖等物质的含量,如果你要想获得活性物质的话,类似毒素、不饱和脂肪酸等反而会减小,而且藻种会退化,过早进入生长衰退期,称为光中毒现象。
如果在生物反应器里面进行培养,后期藻液浓度高到一定程度的时候,我们还是建议客户采用24小时持续光照的。
上海光语生物科技有限公司的60L光生物反应器,可以根据设定的光照亮度值,自动调节led的光强,led的光强会根据藻液变浓而变强!
光照强度lux与光量子强度μmol/m^2-s 一般换算关系
在生产科研过程中会遇到光强 单位和光量子强度单位的换算,这2种单位没有严格的换算关系,是不同的计量方式。
由于光源不同,比例就会改变
主要还是跟光线的组成有关系,不同光源的组成波长会相差好大,光源的能量也会相差很大
1 μmol/m^2-s =55.6 lux ,
1 W/m^2 = 4.6 μmol/m^2-s
1 μmol/m^2-s =71.4 lux,
1 W/m^2 = 5.0 μmol/m^2-s
池塘藻类培养需要不断追肥吗?
在养殖过程中,养殖者忽视了藻类营养的来源,普遍认为中后期投饵量和排泄物的增加,可为藻类生长提供源源不断的营养。其实不然,残饵和排泄物中的营养成分大多要通过生物转化才能被藻类吸收,且可供藻类吸收利用的部分相当有限。因此,中后期适时追肥培藻很有必要。
藻细胞如何破壁?
在提取藻细胞物质的实验之前,不可获取的需要进行藻细胞破壁处理!
比较好的破壁的方法包含液氮研磨、甲醇超声搅拌提取-氯仿萃取、酸溶液冻融。
浓缩小球藻藻液如何使用
市面上很多浓缩小球藻藻液是通过离心的方法获得的,离心对细胞结构会产生很大的破坏,所以显微镜下面看到的小球藻细胞是破碎的不完整的。自然培养的还带有蓝藻,细菌,水体病害病毒等,浓缩后这些致病致死因素浓度更高,极大威胁健康水体的养殖品种。
上海光语生物科技有限公司的浓缩小球藻藻液是通过异养获得的不经过离心就能达到非常高的每毫升100亿完整小球藻细胞个体,使用过程可以按照1:100稀释,每1吨的藻水添加1公斤复合肥。曝气培养,然后再投放到水体里面。
我们保证不含有害病毒、细菌、蓝藻等对养殖品种有威胁的微生物和抗生素产品,致力于为养殖户建立无抗生素的养殖环境而努力。
大规模培藻用什么光源?
培藻用的灯一般用金卤灯, 400或者450w,照度有20000lux,一米距离处,这样才最接近阳光,飞利浦的质量比较好!或者全光谱LED
如何判断小球藻浓缩液的品质?
1、小球藻的培养水体不能含有病害,否则浓缩液导致使用水体出现病害;
2、小球藻的培养水体不能含蓝藻等杂藻细菌,这些蓝藻带到健康水体所带来的水华会毒害养殖品种,降低水体的肥料抑制健康浮游生物生长,水体生态恶化
3、计数方式要科学,小球藻自然水体培养最高浓度就是1000万细胞每毫升,浓缩一下也就是最多10亿细胞了,而号称几百亿都是包含了细菌和病毒细胞的,这种高浓度浓缩液本身就是传播病害和蓝藻的。
4、显微镜镜检能看到完整的小球藻细胞,看不到小球藻细胞的那些都是营养液而已,活体小球藻细胞决定了种群优势是否可以战胜其他蓝藻和病毒获得水体的营养从而抑制其他有害藻类细菌生长!另外就是细胞要完整,如果看到破碎的细胞很多就是经过离心,这种小球藻效果上大打折扣的。
上海光语生物科技有限公司的小球藻浓缩液采用异养培养,3天发酵无菌纯培养后浓度可以在每毫升20-100亿,经过诱导后品质活性叶绿素含量极佳,是目前市面上最可靠的小球藻浓缩液产品,肥水投喂都将保证水体安全和养殖品种健康!
藻类水体和通气量的关系
很多客户问养了10L的藻,这个通气量如何把握呢?一般来说, 雨生红球藻,10L的溶液,进气量是30L/h,密度在每毫升100万细胞左右。
其他藻以此类推,密度高了,通气量就多点,密度低了,通气量就少点
分选藻的时候用什么仪器设备
一般在藻类筛选的时候我们采用的胶头滴管烧了拉细或者毛细管虹吸效应来提取单细胞藻类;也可以用10微升的移液枪长枪头,取一个细胞换一个枪头
充气培养产生泡沫原因分析及解决办法
泡沫是指不溶性气体分散在液体或熔融固体中所形成的分散物系,它是许多聚在一起的小气泡。
一般来讲,大量稳定泡沫的形成常常是因为液体中含有某种表面活性物质,比如大多数的洗衣粉、洗洁精,香皂等。表面活性剂的一端含有亲水基团,另一端含有疏水基团。通气时,液体中的表面活性剂在气体的作用下每个分子的亲水端背靠背排列,亲水端指向一边,憎水端指向另一端,从而形成一个相互相似相容引力的薄膜,即形成了泡沫。
养金鱼的鱼缸也会因为气泵产生泡沫,这是清水气泡,不稳定,极易破碎,通常鱼缸循环水有气泡收集装置,把气泡打碎或者转移。而藻类培养过程中产生的气泡,通常会使培养液变浑浊,粘稠度增大,细胞内的营养物质充当了表面活性吸附剂的作用,形成了大量的气泡,这些细胞往往会凋亡,继而释放难闻的恶气味,培养液呈乳白色。可以说,泡沫是藻生长不良的表征,是细胞衰退走向死亡开始,应特别注意就是。
充气培养过程中产生泡沫原因分析:
1.通气时气泡过大过密集。气泵:选择合适的小功率气泵,连接气阀,旋转气阀调节气体进入强度。气头:选择冒小气泡的气头(bubble size< 2 mm),调节气阀,使气泡最好是一个接一个形成一小串,而不是剧烈通气,气泡造成培养基上部翻动。
2.细胞破碎:气泡过大造成细胞破碎,形成带有颜色的气泡。我做甲藻细胞周期实验,用150L大缸培养,气泡过大,因为甲藻细胞壁较脆弱而破碎,培养液乳白色,形成白色泡沫。
3.染菌:尤其是培养条件不是很好的地方吗,可以在气泵和气头之间可以串联一个0.22微米的滤头,对空气进行过滤,减少细菌的注入。
4.藻类代谢物:我们在培养产油绿藻的时候发现,培养液面层会出现一层白色的膜,经检验不是菌膜,是油脂成分。
总之,充气过程中出现泡沫,一定要注意。
A:藻体分离,离心或者筛绢过滤收集细胞,无菌海水淋洗去除泡沫
B:重新配制培养基
C:抗生素处理细胞
D:重新接种
关于海水高温高压灭菌后析晶问题
藻类培养过程中通常海水需要高压灭菌,无论是人工海水还是自然海水,经0.45/0.22微米滤膜先后过滤之后进行灭菌。但冷却时经常会遇到海水析晶现象:海水里出海针状结晶。有时候即使不打开灭菌锅,一直等海水在灭菌腔自然冷却,仍会出现析晶现象。
原因大概如下:
1.灭菌后体积减少,挥发太多导致盐分析出。
小体积(100毫升以下)可以用0.22微米滤膜过滤除菌。若必须高压灭菌,通常先灭大瓶海水和小空瓶,然后分装。
2.灭菌温度过高,水分蒸发太多而析晶。
我们通常设置灭菌条件:110~115℃,20~30分钟。多次验证表明,不会出现析晶现象。
3.瓶子包扎太严实,内外气压失衡,海水大量喷出。
因此,瓶口勿包扎太紧,灭菌结束取出再拧紧即可。
4.灭菌之后海水最好是自然冷却,水浴降温海水易结晶。
通常是灭菌完成后温度降到70度以下立即取出于室温自然冷却。忌设置保温过夜。
5.营养盐各组分互相反应形成螯合物。
因此,高浓度营养盐母液(NaNO3,NaH2PO4,Vitamins,Trace Metal,EDTA,NH4HCl等等)需要分开配制和保存。灭菌前或接种前添加,添加时用0.22微米滤膜过滤。
此外,硅藻培养实验需要添加硅酸盐(Na2SiO3.9H2O),如果加到海水再灭菌会出现乳白色沉淀。一般也是接种前添加,可用0.22微米滤膜过滤。
小球藻在生产上如何使用能达到最好的效果?
小球藻水产养殖生产中不光是应用于水质处理方面,也是鱼虾蟹的最天然的开口饵料。在人工养殖之前或者自然水体环境中,小球藻是首选的开口饵料。所以,我们应该在苗期之前就把小球藻培育出来作开口饵料,然后再应用到调水环节。
小球藻如果用来调节水质,在以下几种情况是最合适的,一是水清、水瘦、水浑浊无藻种;二是水体倒藻之后急需稳定水质环境和培育优良藻种。这时候水发黑发臭,放小球藻可以快速稳定水体环境和降低鱼虾蟹的应激,从而减少发病的机率。因为小球藻放下去就能繁养,处理水里面的有害物质。三是用来与有害藻类竞争,保持优质藻种的主导地位。
用农家粪或者农家化肥可以满足小球藻的生存繁殖吗?具体怎么操作?
我们的培养基其实也有化肥的成分,但如果是农家粪或者农家化肥必须经过发酵分解成为小分子的有机肥之后才可以投入到水塘,否则在水体里藻类与其它微生物利用不了,鱼虾蟹消化也吸收不了,就会沉到池底使得水发黑发臭,影响水质。所以最好是用小球藻专用培养基或者是水产专用的肥藻膏等产品。如果是硅藻水,比较不稳定。因为硅藻死亡之后,硅藻不容易被细菌分解重新利用,硅藻肥起来的水色难以保证存活周期,但小球藻就不会存在这样的问题。
小球藻生长周期有多长?在任何土质的塘都能生存繁殖吗?
小球藻通过不断吸收营养和光合作用,大概8~12h左右就可以生长繁殖一代,如果营养盐、天气条件、水体环节变化不大的话可以一直生存下去。只要有适合小球藻生存的营养盐、天气以及水质环境,任何土质的塘都可以生长繁殖。如果水质变化不大,塘的肥料条件比较好的话,小球藻可以存活15~20d左右。
小球藻可以在干粉里面培育吗?
我们的小球藻是培育在培养液里面,而不是干粉里面。我们也有些小球藻产品是放在干粉里,但不是应用于水质调节,而是用于苗种天然、优质的开口饵料。所以,我们提供的是培养液保存的鲜活细胞。我们有技术保障小球藻的活性,不会脱水,能够在低温条件存活3~5个月。
使用干粉的任何藻种,包括小球藻是不可能存活的。因为细胞脱水也是会导致死亡的。
小球藻适宜的生活环境以及需要的营养是什么?在水体存活时间长了会不会自然死亡?小球藻浓缩液产品如何保存?
小球藻适宜在25℃~33℃的水体环境下生存,营养盐充足的情况下,小球藻在池塘里培育起来后能达到长期稳定的效果。小球藻对水质指标要求不是太高,特别喜欢氨氮和亚硝酸比较高的水体,需要的营养盐的碳肥和氮肥为主,所以只要池塘满足一定的碳、氮条件就可以保障生存。如果是水泥池,我们也有专门的小球藻培养基供应。
小球藻在自然水体环境里存活时间比较长,因为小球藻属于植物,植物会产生种子,小球藻也一样。理论条件下,只要水体里面营养盐合适、水质及天气条件不是太差的话,小球藻可以通过自身不断的更新换代达到藻相的平衡而一直存活下去。
小球藻浓缩液的保存条件也是低温0℃~4℃,有效期可以达到3~5个月。
市场上有小球藻藻源产品放置会不会分层?销售的小球藻怎么运输?
因为小球藻的保存条件比较苛刻,需要0℃~4℃低温保存,所以藻类销售不是很方便,但产品都是真的。产品放置后一般都会分层,小球藻会沉到底部,上层是抑制活性的培养液。
小球藻销售需要在泡沫箱内放冰袋密封冷藏运输,保证泡沫箱里面的温度是0℃~4℃,可以进行3~5d长途运输。达到目的地之后第一时间放入冰箱继续低温保存,小球藻的品质就不会受到太大影响。
光反应器消毒所用次氯酸浓度
我们一般采用200ppm的次氯酸浸泡12-24小时
有没有简单方法脱出或者提取藻中蛋白质
Bead beating(蛋白反复珠磨法)提取藻中蛋白质效果直接,处理简单
鲁哥氏碘液加冰醋酸的目的是什么?
鲁哥氏碘液,也称鲁哥氏溶液,鲁哥试剂,是碘和碘化钾的水溶液,1829年法国医生J.G..A.Lugol发明,并以其姓名命名,鲁哥氏碘液过去经常被用作消毒剂和杀菌剂,用于饮用水的应急消毒,实验室常规试验和医学检测中检测淀粉。
为什么水泥池养藻重金属会超标
因为在部分水泥的烧制生产过程中,除了将碳酸钙通过高温烧成氧化钙之外,还加入了比例较高矿渣,矿渣包含大量重金属,因此用水泥池养殖需要将水泥池与水体通过塑料薄膜隔离或者用合适的油漆或者防水胶来隔离水泥和水体。
泥鳅吃什么
泥鳅被誉为“水中人参”,其味道鲜美,肉质细嫩,营养丰富。 泥鳅养殖是高效设施渔业发展中涌现出的一项新兴产业。由于具有极高的营养价值与药用功效,泥鳅的市场需求稳健,销售价格相对稳定,从而吸引了不少民间资本投资泥鳅养殖。
在泥鳅育苗阶段需要大量的轮虫和藻类作为泥鳅的开口饵料,而培养轮虫也需要大量的藻类,上海光语生物科技有限公司的浓缩小球藻液具有纯度高,浓度高,蛋白高的特点,采用全球顶尖的异养发酵技术,使得小球藻浓缩液的品质位居活饵产品前列。
国内某大型泥鳅养殖场以轮虫为饵料的泥鳅苗存活率高于仅仅以蛋黄为饲料的实验组,且以单独添加轮虫的清水实验组成活率最高,但是以同时添加小球藻和蛋黄实验组的泥鳅鱼苗最为壮硕、规格整齐。
但蛋黄与轮虫混合投喂并添加了小球藻后,泥鳅鱼苗的成活率大幅度提高,且个体明显大于单独投喂轮虫的鱼苗。由此可见蛋黄所富含的磷脂和胆固醇可以作为泥鳅发育所需的营养,通过轮虫滤食后传递给泥鳅鱼苗,提高了轮虫的营养价值;同时在培育水体中添加小球藻,既减少了蛋黄对水质的负面影响并稳定了水质,又起到强化轮虫营养的作用。
因为泥鳅鱼苗游动能力较弱,主动摄食能力不强,因此在投喂饵料的方法上还要注意以下几个问题。
①投喂蛋黄时要均匀,并采用少量多次的方法,避免或减少下沉。
②尽量采用轮虫与蛋黄搭配组合的方法投喂,充分利用轮虫和蛋黄营养的互补性,减少了蛋黄恶化水质的可能性。
③少量补充单细胞藻类,利用藻类的光合作用增加水体溶氧并净化水质,同时避免藻类浓度过高,影响泥鳅鱼苗的正常发育。
④保持一定的充气量,维持水中的溶解氧,促进有机物好氧分解,避免有机物厌氧分解产生有毒的中间物质和终产物,维持和改善水质。同时连续曝气可以减少蛋黄等饵料下沉并使之分布均匀;但是充气以微沸状态为宜,避免泥鳅鱼苗逆水游动而耗费体力。
由此可见,泥鳅养殖需要大量的轮虫和小球藻,轮虫的培养也需要大量的小球藻,稳定和优质的小球藻供应是泥鳅养殖的必须掌控的重要环节。
上海光语生物科技有限公司所采用的小球藻异养发酵技术,产能不受天气影响,保证稳定供给,可以根据客户需求定制小球藻的营养组成,同时可以根据用途不同,采用不同工艺将小球藻浓缩液做成投喂功能和肥水功能两种规格。
实验容器瓶高温高压灭菌前怎么处理好
问:实验容器瓶高温高压灭菌前怎么处理好?瓶盖要拧松吧?要用牛皮纸包着瓶盖和瓶口吗?或者锡箔纸
答:水不能太满,一般到75%。盖子拧到一半松紧即可。不需要再进行牛皮纸等包裹
问:灭那种磨砂的细口瓶呢?那种瓶盖可能会因为自身重力的原因没法让瓶口保持通气啊
答:那就包上铝箔吧,然后把瓶塞再用铝箔单独包裹
为什么有机玻璃(亚克力)管材板材变黄
传统的有机玻璃合成是以甲基丙烯酸甲酯为原料经自由基引发(或离子型引发)聚合而成。引发剂通常为偶氮二异丁腈或过氧化二苯甲酰,其聚合通式如下:
在本体聚合反应开始前,通常有一段诱导期,聚合速度为零。在这段时间内,体系无粘度变化。然后聚合反应开始,单体转化率逐步提高,当转化率达到20﹪左右时,聚合速度明显加快,称为自动加速现象。此时若控制不当,体系将发生暴聚而使产品性能变坏。转化率达到80﹪之后,聚合速度显著减低,最后几乎停止反应,需要升高温度来促使聚合反应的完全进行。 甲基丙烯酸甲脂聚合过程中出现的自动加速现象主要是由于聚合热排除困难,体系局部过热,有机玻璃会变黄。聚合过程中聚合热的排除问题是本体聚合中最大的工艺问题。
水产中,100ppm次氯酸钠溶液,需要多少硫代硫酸钠中和?
1ml10%有效氯的次氯酸钠溶液一般用0.25-0.3g硫代硫酸钠(大苏打)中和,温度会有影响,中和时间不能少于2小时,混匀是必须的
工业纯 化学纯 分析纯 色谱纯 医药级 食品级
工业纯、化学纯、分析纯和色谱纯是按纯度分级的,工业纯的纯度最低,色谱纯的纯度最高,分别用于工业生产、普通化学试验、分析试验以及色谱分析。
吸光光度测藻密度采用750的原因
吸光度测出来数据要求跟细胞密度有关,细胞在各个时期的叶绿素含量是不同的,细胞密度也是不同的,680测出来就乱了。
细胞样品流式分析前期处理步骤
- 离心去除培养基,灭菌海水洗涤一次
- 加入1 mL的磷酸盐缓冲液(1×PBS)重悬,再加入700 μL的70%乙醇,-80℃储存备用
- 实验前离心,加入70%乙醇反复洗涤去除色素至上清无色
- 向沉淀中加入1 mL的PBS洗涤去上清,再加入1 mL用PBS配置的0.3% Triton X-100,室温下静置40分钟,离心,PBS洗涤,重悬,向重悬液中加入4 μL的RNase A,37℃水浴1小时,PBS洗涤,重悬,再加入10 μL的2.5 mg/mL碘化丙啶(PI)溶液,室温遮光10分钟
- FL3通道检测DNA含量,激发光波波长520 nm,收集30,000个细胞,用MultiCycle软件计算细胞处于G1,S,G2+M期的相对百分比,运行Win MDI 2.9软件对实验数据进行分析。
工业盐、大盐、海水直接晒干的盐、食用盐的区别
工业盐:工业盐是在矿山开采出来的矿物盐和化学合成的有盐性质的化学原料,广义的工业盐指所有用于工业的盐类,而氯化钠只是其中一种,为了区别,常常把非食用的氯化钠直接叫做工业盐。
海水直接晒的盐就是大盐,经过粉碎洗涤以后,可以用于腌制,也就是市场上的粉洗盐。以往的大颗粒海盐也是食用盐,由于不卫生已经不允许直接食用了,主要作为工业盐。经过过滤就是精盐。
食用盐:简单说氯化钠既可以食用,也可以工业用,只是食用的有较高的卫生要求,还要加碘而已。至于海盐、井矿盐的区别是生产工艺和原料来源不同,主要成分都是氯化钠,按食用盐标准生产的就是食用盐,按工业盐标准生产的就是工业盐。
我们平时商店里买来的食盐,都是经过严格加工制造的,可是在一些地方,常发现食用“粗盐”,甚至食用工业用盐中毒事件的发生。那么,什么是“粗盐”?什么是工业用盐?它们与食用盐有什么不同呢?
“粗盐”是指未精炼的海盐,湖盐或井盐,主要由不法商贩私自销售的,有些人认为散装的大粒结晶的“粗盐”,盐分高,价格便宜,喜欢买来直接食用或用来腌菜等,因此,常常发生中毒,尤其在农村地区多见,有的称为“痺病”。
“粗盐”中主要有毒成份为氯化钡,食用后进入人体,主要分布在肌肉中,它是一种肌肉毒,可使中毒人出现面部、四肢针刺样发麻感,肌肉震颤、痉挛、抽搐 ;严重者肌肉逐渐瘫痪,瞳孔扩大而不能调节,舌肌麻痹发音困难;呼吸肌麻痹而出现呼吸困难者,随时可因心脏停搏和呼吸肌麻痹而死亡。
工业盐并不是盐,可在有些百姓的眼里认为工为用盐也是盐,只不过比食用盐粗糙一些,有时误将其放入炒菜、腌菜中,食入后发生中毒,工业盐是一种化学物质——亚硝酸钠,它除在化学工业应用外,在建筑业上用作钢筋的防锈剂。因亚硝酸钠有咸味,无臭,外形极似食盐、糖等,有些人还把它误加入饮料、糕点中。
误食“粗盐”中毒后:
1、应立即催吐将钡剂排出,洗胃前,口服硫酸钠20-30g,并多饮水,使毒草物变为一水溶性的硫酸钡,再用2-5%的硫酸钠液或温水洗胃,直至澄清为止。
2、洗胃后将琉酸钠10-30g溶于200-300ml水中内服或灌入胃内,1小时后可重复应用。
3、严重者可用1%硫酸钠10ml缓慢静注,每隔30分1 次,直至症状消失。也可用1-2%硫酸钠注射液500-1000ml缓慢滴注,可连用2-3天。中毒较轻,可用硫酸钠内服。如无硫酸钠,可先用10-20%硫代硫酸钠10-20ml静注,再设法用硫酸钠静注。
4、注意补钾,防治心律失常,营养心肌。
5、呼吸麻痹时,应立即进行人工呼吸,必要时作气管插管或切开,给予呼吸中枢兴奋剂。
服工业盐中毒要比蔬菜等引起的亚硝酸盐中毒严重,其表现和治疗与其相同,请参考“食含亚硝酸盐中毒及处理”。
如何防止在光合细菌培养过程中的绿藻污染问题
在光合细菌的培养过程中,经常会遇到污染绿藻的问题,很多培养户为此头痛不已,可以肯定的是国内所有出售光合细菌培养基的厂家都有这个问题,绿藻的污染,使培养液变成绿色或绿色为主的颜色,不仅使整批物料作废,而且威胁下批物料培养的成功率。目前对此问题还没有很好的解决方法,只能有针对性地进行预防。
什么是微分干涉差显微镜(DIC显微镜)
1952年,Nomarski在相差显微镜原理的基础上发明了微分干涉差显微镜(differential interference contrast microscope)。DIC显微镜又称Nomarski相差显微镜(Nomarki contrast microscope),其优点是能显示结构的三维立体投影影像。与相差显微镜相比,其标本可略厚一点,折射率差别更大,故影像的立体感更强。
什么是相差显微镜?
活细胞和未染色的生物标本,因细胞各部细微结构的折射率和厚度的不同,光波通过时,波长和振幅并不发生变化,仅相位发生变化(振幅差),这种振幅差人眼无法观察。而相差显微镜通过改变这种相位差,并利用光的衍射和干涉现象,把相差变为振幅差来观察活细胞和未染色的标本。相差显微镜和普通显微镜的区别是:用环状光阑代替可变光阑, 用带相板的物镜代替普通物镜,并带有一个合轴用的望远镜。
什么是光生物反应器
光生物反应器是设计有光源系统的主体为透明材料的生物反应培养设备,主要用于可进行光合作用的微藻、植物细胞、光合细菌的培养。
封闭式光反应器
敞开式培养系统
系统比较
什么是 灭藻剂
灭藻剂 简介
灭藻剂 在不同的PH值范围内均有很好的杀菌灭藻能力,能有效地挖去藻类繁殖和粘泥增长,并有分散和渗透作用,能渗透并去除粘泥和剥离附着的藻类,此外,还有去油能力。 灭藻剂的主要成分: 十二烷基二甲基苄基氯化铵。
适用范围
适用于各种水体 系统的藻类、微生物的杀灭如:鱼塘、池塘、河道、大型中央空调、工程热交换、制程等循环冷却水 系统的处理。
特性
该药剂属于复合制剂具有广普的杀菌能力,能有效的渗透细胞壁、分解细胞的DNA从而杀死并抑制其繁殖。本产品高效低毒,自然分 解周期短,环境介面友好、处理效能稳定。对高级水生动物基本无任何影响。是新一代广泛推广的环 保型水处理理想之杀菌灭藻药剂.
物性外观
| 项目 | 指标 | ​ |
| 外观 | 无色或淡黄色透明液体 | 淡黄色蜡状固体获胶体 |
| 活性物含量% ≥ | 45 | 90 |
| 胺盐含量% ≤ | 3.0 | 8.0 |
| PH值 | 6.0-8.0 | 6.0-8.0 |
使用方法
作非氧化性 灭藻剂 ,一般投加剂量为50-100mg/L;作粘泥剥离剂,使用量为200-300mg/L,需要时可投加适量有机硅类消泡剂。灭藻剂可与其它杀菌剂,例如异噻唑啉酮、戊二醛、二硫氰基甲烷等配合使用,可起到增效作用,但不能与氯酚类药剂共同使用。投加1227后循环水中因剥离而出现污物,应及时滤除或捞出,以免泡沫消失后沉积。 。
杀菌灭藻剂的用途
包装及贮存
灭藻剂采用塑料桶装,贮存于室内通风阴凉处,避免阳光直射。
灭藻原理
灭藻剂与菌藻接触后,快速断开细菌和藻类蛋白质的键不可逆地抑制其生长、新陈代谢。从而导致微生物菌藻的死亡,故对常见细菌、真菌、藻类等具有很强的抑制和杀灭作用。杀生效率高,降解性好,具有不产生残留、操作安全、配伍性好、稳定性强、使用成本低等特点。杀灭藻类的同时并对对附着在管道壁上的生物粘泥有优异好的剥离效果。
光合细菌有哪些分类
蓝细菌(Cyanobacter)
紫色细菌
如何培养硝化菌
提供够大的表面积,硝化菌须要表面覆着.通常砂子跟生化棉或是陶瓷环都是一样的作用,提供表面积。另外 需要充足水流流经,提供氧气。这也就是为什么裸缸永远不会像砂缸那样稳定。裸缸中很难培养足够的硝化菌,菌相很难达稳定
硝化菌培养还需要注意什么
硝化菌是厌光的,所以开灯并不会增加硝化菌的培养。反而硝化菌喜好没有光线的生长环境。
虽然硝化菌需要O2…但是CO2也是硝化菌不可或缺的化学能之一,如果没有CO2硝化菌生长会受到抑制的,硝化菌除了会氧化亚硝酸(NO2)以及氨(NH3)取得它需要的能量之外…还需要碳原才能建构其个体以及提供能量。而NO2、O2以及NH3都没有碳原…那怎麽提供呢?刚好硝化菌可以将CO2的C(碳)给分解出…并且C被取走了就剩下氧气。所以CO2的地位与O2一样相当重要喔!
消化菌比较正确的名称为 “异营菌。硝化菌并无法分解大便 主要由异营菌来分解大便。有人说硝化菌只需2~3天就可以建立完成。刚好藉着这篇稍微说明一下。这是不可能的。如果这麽简单就可以建立的话就不会显得硝化菌的重要以及就不会有新缸症候群了,至於要花多久时间才能培养,一般是至少要四个礼拜
(按: 个人觉得如果适当的添加”有效的” 硝化菌种 可以快一点建立菌相 只是2~3天 尚无法建立稳定菌相。)
观赏水族中需要买光合菌吗
光合菌主要用在水产养殖上,对于水族观赏,只要你缸内菌相完整 光合菌是不须要的,而且加了光合菌 他也只能幫你作用個二三天 然後就會死掉,功用不太大,而且只有短期作用
为什么买的液装硝化菌没什么作用?
一分钱一分货 我找了很多间水族馆 发现现在液装硝化菌超便宜,一大罐100ml 很大一罐 但上头无生产日期 无保存日期,这样子的东西 是不太可能会有用的 里面大概都是些化学药品居多吧。真正好的液装硝化菌 会标期限 要在半年内使用
我买的硝化菌很臭 正常吗?
如果你确定你买的是硝化菌 那你就是被骗了,真正的液装硝化菌不会臭 因为它们不靠有机物过活 液体不可能会臭。会臭的 大概里面装的是”消化菌” 硝化菌液应该呈现半透明 没太多沉淀物 也不会臭的
在水产养殖中使用光合细菌有什么好处?
水质恶化、鱼病暴发,因为水体缺氧导致大量死鱼的现象在各地水产养殖场可以说是非常常见;因为大量投饵导致水体变质引起鳝鱼发病而不得不提前低价卖掉的现象可以说是年年屡见不鲜。养殖者渴求有一种能够快速改善水质的神奇产品。
光合细菌对改善水质有着非常神奇的效果,将光合细菌泼洒入污染严重的池塘中,一般在3小时后,水质开始转清,第二天去看,与周围没有泼洒光合细菌的池塘相比,水质有天壤之别,一看便知。若鱼病很严重,每天均有死鱼浮面的话,则用了光合细菌后,第二天去看,浮面的死鱼显著减少,直到消失,与周围形成鲜明对比。
用了光合细菌,还可有效地帮助鱼虾安全越冬,冬季不但不减产,反而有增产。
用了光合细菌的水产品,颜色鲜艳,个体整齐,鱼肉鲜嫩!
用光合细菌稀释10倍后,对鱼虾进行药浴,可使鱼虾成活率达到90%以上,发粘细菌病、烂鳃病、打印病、成活率达60-100%,水霉病、赤鳍病、擦伤病成活率达近100%,与其它化学药物相比,更加安全可靠,无任何药浴副作用。用了光合细菌一般亩产提高15-23%,饵料系数下降18-23%,成活率提高20-60%,个体增重提高15%,投入产出比达1:10以上。每亩可以增加效益达800元以上。
每年夏天缺氧死鱼1万多斤的水库,去年按量泼洒光合细菌后,整个夏天仅出现不到100条死鱼,而且基本没有再开增氧机;各大养鳝区10月份就有大量养殖户提前低价卖黄鳝,而我们在江苏等地普遍泼洒光合细菌的养鳝户中,却没有发现一户有这样的现象……
由于光合细菌系水剂,包装、运输成本高昂,一般市场售价高达每公斤5-8元。按规定用量使用一个夏天,一般每亩投入需要150-200元。一些养殖户为了节约开支,将每亩施用5公斤的常规用量降低到仅用1公斤,导致净化水质的效果大打折扣。
按照上海光语生物科技有限公司的培育方法加入菌种和水,即可在3-5天时间培养出大量的合格光合细菌菌液,产品符合国家相关标准(每毫升含光合细菌30亿以上),每公斤光合细菌菌液的生产成本在0.3元以内。这样,按规定标准进行使用,每亩每次也仅需花费1元多钱,一年泼洒6次也不到10元钱。
培育光合细菌需要哪些条件?
1、 营养条件
光合细菌细胞体构成元素主要有:碳、氢、氧、氮、磷、钾、钠、镁、钙、硫和一些微量元素等,它们也是所有生物细胞构成的主要物质。一般情况下,细胞鲜重:水占80%-90%、无机盐1%-1.5%、蛋白质7%-10%、脂肪1%-2%、糖类和其它有机物1%-1.5%。其中干细胞含碳45%-55%、氢5%-10%、氧20%-30%、氮5%-13%、磷3%-5%、其它矿物元素3%-5%。光合细菌的细胞壁具有半透性,能选择性地让一些营养元素按一定比例进入,在酶的作用下合成自己的细胞组织和裂变的新个体。
营养元素的全面和搭配的合理,是营养条件的关键。根据这一要求,选用多种无基原料,科学配方,经特殊加工而成的”光合细菌培养基”,基本符合光合细菌生长繁殖所需的营养要求,无毒无副作用,使用安全,固状结晶体便于包装和运输,而且有2年的保质期。用其生产菌液(每毫升含有30-50亿个活菌体),每公斤成本不到0.3元,且现制现用,质量明显优于市场出售的同类产品。
光合细菌培养基,是光合细菌生长繁殖所需各种营养元素的组合体。每种原料都能得以充分利用,最大限度地生产高浓度的菌液,因此,单位效价的光合细菌菌液生产成本低、质量好,这无论是对于用户、经销商还是厂家都有很大的益处,对在工农业生产中的推广和普及将产生深远的影响。
2.环境条件
有了营养全面的光合细菌培养基,只是给光合细菌提供了“食物”,还需要有适宜光合细菌生长的环境条件,才能培养出优质的菌液。环境条件具体有以下几个方面:
(1)培养介质:含菌量较低的清洁淡水、海水或加粗食盐的淡水。从经济、实用的角度考虑,地下水含菌量低,为最佳水源;清洁的地表水也可使用;含氯量较高的自来水应敞口放置两三天或调PH值至偏碱后使用;蒸馏水及纯净水固然很好,但成本太高,可用于提纯菌种。
(2)酸碱度(PH)值:7.5-8.5最佳(适应范围6-10)。
(3)水硬度:PH值中性时10度以下。即调节PH值至8.0左右时,培养介质中的乳白色沉淀物不宜过多。
(4)温度:25℃-34℃最佳(适应范围15℃-40℃)。
(5)光照度:3000LX-4000LX最佳。即每25千克菌液需用60瓦左右的电灯泡进行光照,当然,太阳光最好且无需成本。
(6)透气性:密闭、敞口皆可培养,密闭效果更好。
(7)容器:透明或白色容器;大规模培养可用土池、水泥池等,菌液深度30厘米以下为佳。
光合细菌有什么作用?
光合细菌生命力、适应性都很强,在生长繁殖过程中能分解有机物和吸收水体中的氨态氮、硫化氢、亚硝酸盐等有害物质,本身无毒无污染。它在光照厌氧条件下生长旺盛,在无光黑暗通气条件下亦能生长,但不合成红色素,易经诱导产生广泛的适应酶,对降解某些有毒或人工合成化合物具有潜力;耐低温(即使冰冻也不会死亡)和高盐度(20%),适合处理高浓度有机废水,是优良的水环境改良剂。
光合细菌菌体营养丰富,含蛋白质(60%以上),维生素B12、叶酸、核黄素、类胡罗卜素、辅酶Q10等促长因子和生理活性物质,是优良的饲料添加剂。
光合细菌以土壤接受的光和热为能源,将有机和无机营养物质转化成易为植物吸收的小分子物质。同时光合细菌除本身的有机营养物质外,还含有铜、锌、钼、钴、镍等微量元素,含量适中,施用后,可补充土壤所缺,提高肥效,是优良的植物肥料。
光合细菌应用
(1)养殖业
我国是养殖大国,近年来,养殖业取得了很大的发展。但是,传统的水产和畜禽养殖成本高,产量小,效益低,特别是养殖中使用的各种消毒剂和抗生素,即破坏养殖环境,污染水产品,又增加养殖成本。如何有效地克服上述缺点呢?光合细菌作为优良的水环境改良剂和饲料添加剂,用于养殖业在我国才是近几年的事,由于最早使用光合细菌的用户,取得了很好的效果和较大的经济效益,因此目前倍受推崇,大有普及之势。那么,光合细菌究竟起到什么样的作用呢?
① 净化水质
由于高密度水产养殖的水体中,含有大量的鱼类粪便和残饵,以及鱼药的残留物,它们腐败后产生的有害物质直接污染水体和底泥。轻度污染可造成鱼类生活不适,饲料系数增高,生长缓慢,免疫力下降;积累到一定程度后,能使鱼类中毒、发病甚至死亡。这是由于有害物质,除直接危害鱼类外,同时也是病原微生物的营养源,并使之大量繁殖,使鱼类感染发病。兼性厌氧的光合细菌能改善水质的主要原因,是它在分解有机质时不产生有害物质,并且还能利用有害物质作为营养源,长成自已的有益细胞,变害为宝;形成优势群落后,还能竞争性地抑制病原微生物的生长,降低感染机率。从而净化水质使鱼类健康生长。
② 维持微生态平衡
养殖的水体中存在着各种各样的微生物,有的是有益的;有的是有害的;有的处于中间状态,叫”条件致病微生物”,即正常情况下,这类微生物不致病,但在水质恶化,鱼类免疫力下降时,便大量繁殖危害鱼类。自然界中,有害微生物和条件致病微生物都叫”病原微生物”是不可排除的,广义上讲,它们有利于生物进化。它们能使一些不健康的、免疫力低或退化了的生物体被淘汰。但是,无论是有害微生物还是条件致病微生物,必须在水体中达到一定浓度才能危害鱼类,这个浓度叫”发病临界点”。不同种或不同体质的鱼,发病临界点不一定相同。在渔业生产中,控制病原微生物的浓度,使其达不到发病临界点,是健康养殖的关键。通常人们采用消毒杀菌剂来控制,但随着施用次数的增加,病原微生物的耐药性亦相应增强,为了达到预防效果,施用剂量逐步加大,这不仅增加了用药成本,还污染了水体,造成水产品品质下降,甚至不能食用。同时鱼类易产生应激反应,停食、消瘦,浪费有限的生长期。到了鱼类发病需要治疗的时候,安全剂量治不了病,大剂量施用又容易对鱼类产生危害,这个矛盾制约了水产业的发展。
如何控制病原微生物的生长繁殖,并使其不产生耐药性呢?光合细菌可基本克服消毒杀菌剂的缺点,它通过降解或清除水体中包括鱼药在内的有害化学物质;与病原微生物争夺营养、空间,使其无法大量繁殖,从而不易形成致病的环境条件。假如由于病原微生物的原因,鱼类发了病,说明它在水体中的浓度已达到或超过发病临界点,在微生物群体中占优势,此时,再用光合细菌治疗是没有明显效果的.须用消毒杀菌剂治疗,6-7天后,再施用光合细菌保养水质。
鱼类病害防治原则是:防重于治。只有在日常渔业生产中,维持水体微生态平衡,使有益微生物始终占绝对优势,才是健康养殖的出路。如果平时不有效地预防,到了出现症状时再去治疗,那么,包括鱼药成本在内的重大损失将是不可避免的。
③ 培养浮游动物作饵料
光合细菌营养丰富,这正是浮游动物的优质饵料。实践证明,水体中光合细菌越多,浮游动物生长繁殖越旺盛,以浮游动物为食的鱼类增产效果也就越明显,如虾、蟹、花鲢、河蚌等。浮游动物作为仔鱼、糠虾、贝苗等开口饵料,营养价值高,易于消化吸收。此外,光合细菌对于刚孵化后,还不能主动捕食的仔鱼是最适宜的饵料,此时仔鱼的消化系统各器官尚未完全分化,光合细菌通过鳃被吸入体内,在卵囊尚未被完全吸收的同时,即可从外界摄取营养,以弥补内源性营养的不足,从而大大提高成活率。
④ 间接增氧
光合细菌分解有机质进行生长繁殖时,不需要氧气,也不释放氧气,它节约了好氧微生物分解有机质时所需的氧,产生间接增氧作用。
⑤ 饲料添加剂
在相对营养不良的情况下,养殖动物的免疫力下降,有害菌得以发展,容易出现疾病症状。一般情况下,配合饲料中的活性营养成份较少,饲料系数较高。光合细菌作为优良的饲料添加剂,含有大量的促长因子和生理活性物质,营养丰富,拌和饲料后,可补充和增加饲料营养成份、降低饲料系数;刺激动物免疫系统,促进胃肠道内的有益菌生长繁殖,增强消化和抗病能力,促进生长。
(2)种植业
光合细菌肯有很强的固氮能力,能够改善土壤的营养结构,肥沃土壤,可作为基肥、追肥。光全细菌在土壤中大量生长繁殖,有利于土壤中有效力微生物(如放射线菌)的生长,减少有害菌群(如丝状真菌)引起的病害。
光合细菌在农作物上使用,用于水稻和小麦,有利于根系发育,提高有效分蘖和成穗数,用于蔬菜及花卉等,可提高产量和品质,延长保鲜期;用于浸泡种子,发芽率高、生长速度快、抗病力强。对棉花的枯黄、草莓的根腐病等防治效果显著。
(3)环保业
生物学污水处理法是指通过微生物酶的作用,分解和合成有机质。其中起主要作用的是细菌,污水中一些可溶性的有机物在胞内酶的作用下被菌体选择性地吸收;颗粒、胶体等难溶或不溶性的有机物先附着在菌体外,由菌细胞分泌的胞外酶分解成脂溶性和水溶性物质,再被菌体吸收。通过微生物体内的生化作用,将一部分有机物同化成自身,另一部分被异化成水分子有机物、二氧化碳、水等,从而使污染物质得到降解。
光合细菌兼性厌氧的特性和很强的适应性,使其在污水发酵处理中,作用日益突出。例如光合细菌(荚膜红假单胞菌)可将致癌物亚硝胺转化为无毒的化合物,对于生化需氧量(BOD)高达数千mg/L的有机废水,一些生物膜法及活性污泥法等需氧处理法难以耐受,而光合细菌则可以承受,故在处理高浓度有机废水方面具有广泛的应用前景。
什么是微藻能源
藻类是最低等、最古老的一类植物。虽说结构简单,它却能产出一种生物“原油”,这种生物“原油”相当于石油的原油,可用来提炼汽油、柴油、航空燃油,以及作为塑料制品和药物的原料。同时,多数藻类植物还能制造出大量的碳水化合物等中间产品,这些产品经过发酵处理可以转化为乙醇燃料。可以说,藻类植物与生物燃料“缘分”很多。
二次世界大战期间,美国有个著名的、研制原子弹的“曼哈顿计划”。如今,美国又出了个“微型曼哈顿计划”,不过,它的宗旨不是研制原子弹,而是向藻类植物要油,以帮助美国摆脱严重依赖进口油的能源窘境。 不仅如此,这一计划更令人瞩目的是,它重新燃起了美国新一轮的藻类生物“原油”研发热潮。
藻类产生能源 同时解决气候问题
近日,由沈阳院承担的“新型能源藻培养与能源产品转化技术”项目启动暨工作交流会在沈阳召开,主要是开发能源藻类大规模培养和藻基生物能源产品制备技术,对推进我国能源多元化进程,缓解气候环境保护压力,保障我国能源安全和社会可持续发展均具有重大意义,该项目是“863计划”先进能源技术领域的重点项目之一。
“新型能源藻培养与能源产品转化技术”项目,将包括能源藻类大规模培养技术和藻基生物能源产品制备技术的开发。该项目包含3个子课题,分别为“富油能源微藻培育与生物柴油制备”、“藻类航空煤油制备技术”和“基于能源藻原料的生物能源产品的制备技术”,其中沈阳院作为项目牵头单位,承担了“富油能源微藻培育与生物柴油制备”子课题。
上海光语生物科技有限公司提供的光生物反应器,可以为客户提供合适的反应培养容器用来筛选合适的藻种和进行有效的营养分析。
新的水族缸里的水看起来一直雾雾的,换了水还是会雾?
因为缸子中菌相尚未建立 消化菌及硝化菌都尚未存在 换再多水 还是会起雾的感觉。建议先设好缸子 让水动几天後 再放入鱼只 初期喂食量不要太多 让菌种微生态系统慢慢稳定!
什么是硝化菌
都是叫 消硝 但和消化菌大大的不同
也是很多人会搞错的地方
硝化菌 也是一大群细菌的总称
为好氧性菌
无法分解有机物 也就是无法分解大便或是饲料
而是将水中的氨或亚硝酸分解 ( 分解为较无毒的物质 )
通常这二种物质就是水中的有毒物质
也是水闻起来有腥味或臭味的因素
什么是EM菌
EM菌(Effective Microorganisms)是由大约80种微生物组成, EM菌由日本琉球大学的比嘉照教授1968年研究成功,于80年代投入市场。 EM菌是 以光 合细 菌、乳酸 菌、酵母 菌 和放 线菌 为主 的 6 个属 56余个微生物复合而成的一 种微生 活菌 制剂。作用机 理是形成EM菌和 病原 微生物 争夺营 养的竞争,由于em菌在土壤 中极易生 存繁 殖,所以能较快 而 稳 定地占 据土 壤 中的生态地 位,形成有 益的微生 物菌的优势群落,从 而 控制病 原 微生物的 繁 殖和 对作 物 的侵袭。80年代末90年代初,EM菌 已被 日本、泰 国、巴 西、美 国、印度尼西 亚、斯里 兰卡 等 国广 泛应 用干农 业、环 保等领域,取得了 明显的经济效益 和生态效益。
EM = Effective Microorganism (有益微生物群)
是由光合菌群、乳酸菌群、酵母菌群、革兰氏阳性放线菌群、发酵系的丝状菌群共五科10属80多种有益菌共生共荣组成的新型微生物制剂。它的发明人是日本琉球大学比嘉照夫教授。EM原露技术自1991年引入中国,经证明其适用于农作物种植业、畜禽饲养业、水产养殖业、环保业和人体保健。
What is “EM”?
This exception is “EM”, standing for “effective microorganisms”. EM products were developed by T. Higa of Ryukyu University, Okinawa. They contain abundant anaerobic lactic acid bacteria and yeasts, as well as other microorganisms. The utilization of these anaerobic microorganisms is a distinctive feature which distinguishes EM from other microbial products. EM first attracted notice in garbage treatment by local governments that were struggling to cope with the increasing amount of garbage. The EM manufacturer claimed that individual households could make “compost” of good quality in one or two weeks using a sealed plastic bag or container containing cooking refuse mixed with an EM product. Although anaerobic fermentation usually generates an unpleasant odor, EM products were claimed to suppress any bad smells by producing lactic acid. Higa claimed that the “compost” thus prepared could be used in a home garden or distributed to farmers. This idea attracted local governments, who hoped it would cut down on the cost of garbage treatment, as well as citizens who appreciated the importance of recycling. The “compost” thus prepared, however, has a very high water content, because water vapor cannot escape from a sealed bag. It also contains a large amount of available organic matter, because the decomposition of organic matter is incomplete, as with the making of silage or pickles. Incorporating available organic matter into the soil causes an explosive proliferation of pathogenic “sugar fungi” such as Physium and Rhizoctonia. Therefore, many crop failures have occurred when seeds were sown just after application of the “compost”. Some farmers’ groups are now making bokashi from this garbage compost by drying it, mixing it with other materials, and composting this mixture further.
1、光合菌群(好气性和嫌气性)。如光合细菌和蓝藻类。属于独立营养微生物 ,菌体本身含60%以上的蛋白质,且富含多种维生素,还含有辅酶Q10、抗病毒物质和促生长因子;它以土壤接受的光和热为能源,将土壤中的硫氢和碳氢化合物中的氢分离出来,变有害物质为无害物质,并以植物根部的分泌物、土壤中的有机物、有害气体(硫化氢等)及二氧化碳、氮等为基质,合成糖类、氨基酸类、维生素类、氮素化合物、抗病毒物质和生理活性物质等,是肥沃土壤和促进动植物生长的主要力量。光合菌群的代谢物质可以被植物直接吸收,还可以成为其它微生物繁殖的养分。光合细菌如果增殖,其它的有益微生物也会增殖。例如:VA菌根菌以光合菌分泌的氨基酸为食饵 ,它既能溶解不溶性磷,又能与固氮菌共生,使其固氮能力成倍提高。
2、乳酸菌群(嫌气性)。以嗜酸乳杆菌为主导。它靠摄取光合细菌、酵母菌产生的糖类形成乳酸。乳酸具有很强的杀菌能力,能有效抑制有害微生物的活动和有机物的急剧腐败分解。乳酸菌能够分解在常态下不易分解的木质素和纤维素,并使有机物发酵分解。乳酸菌还能够抑制连作障碍产生的致病菌增殖。致病菌活跃,有害线虫会急剧增加,植物就会衰弱,乳酸菌抑制了致病菌,有害线虫便会逐渐消失。
3、酵母菌群(好气性)。它利用植物根部产生的分泌物、光合菌合成的氨基酸、糖类及其它有机物质产生发酵力,合成促进根系生长及细胞分裂的活性化物质。酵母菌在EM原露中对于促进其它有效微生物(如乳酸菌、放线菌)增殖所需要的基质(食物)提供重要的给养保障。此外,酵母菌产生的单细胞蛋白是动物不可缺少的养分。
4、放线菌群(好气性)。
5、发酵系的丝状菌群(嫌气性)。
如何找到合适的藻类培养容器

目前情况下藻类培养普遍使用5L的锥形瓶,放在恒温箱或者光照控制箱里面。如果在使用营养分析和生长环境试验就会使得各个容器的环境不是严格意义上的一致。如果用在养殖生产上,连续培养也找不到合适的容器。
上海光语生物科技有限公司为客户提供标准的60L连续培养光生物反应培养器,具有搅拌,充气,测温,测光照,自动控温,控制光照的功能。欢迎客户来电咨询。可培养实验或者生产使用的光合细菌,海水藻,淡水藻等,满足自动化培养和采摘浓度标准化控制。
什么是光合细菌
光合细菌为自营菌 也是一大群细菌的总称 , 为厌氧性菌 能在光线充足的地方自行光合作用,能帮助分解水中有机物质
不过因为他是厌氧性菌 在大自然中通常存在泥土或氧气少的地方 ,在养殖水体中无法长期存在 添加後几天内就会失去效用,因此必须定期再添加 ,不属於水族箱中长存的菌种
光合细菌,消化细菌,硝化细菌这三个细菌都是不同的菌,水族箱中以前二者较为重要,也关系者水族箱中菌相平衡的一大因素
英文名: Photosynthetic Bacteria (Abbr. name: PSB )光合细菌(简称PSB)是地球上出现最早、自然界中普遍存在、具有原始光能合成体系的原核生物,是在厌氧条件下进行不放氧光合作用的细菌的总称,是一类没有形成芽孢能力的革兰氏阴性菌,是一类以光作为能源、能在厌氧光照或好氧黑暗条件下利用自然界中的有机物、硫化物、氨等作为供氢体兼碳源进行光合作用的微生物。光合细菌广泛分布于自然界的土壤、水田、沼泽、湖泊、江海等处,主要分布于水生环境中光线能透射到的缺氧区。
光合细菌在有光照缺氧的环境中能进行光合作用,利用光能进行光合作用,利用光能同化二氧化碳,与绿色植物不同的是,它们的光合作用是不产氧的。光合细菌细胞内只有一个光系统,即PSI,光合作用的原始供氢体不是水,而是H2S (或一些有机物),这样它进行光合作用的结果是产生了H2,分解有机物,同时还能固定空气的分子氮生氨。光合细菌在自身的同化代谢过程中,又完成了产氢、固氮、分解有机物三个自然界物质循环中极为重要的化学过程。这些独特的生理特性使它们在生态系统中的地位显得极为重要。
在水产养殖中运用的光合细菌主要是光能异养型红螺菌科(Rhodospirillaceae)中的一些品种,例如沼泽红假单胞菌(Rhodop seudanonas palustris);
在自然界淡、海水中通常每毫升含有近百个PSB菌,光合细菌的菌体以有机酸、氨基酸、氨和醣类等有机物和硫化氢作为供氧体,通过光合磷酸化获得能量,在水中光照条件下可直接利用降解有机质和硫化氢并使自身得以增殖,同进净化了水体。
除此之外,细胞内还含有碳素储存物质糖原和聚β一羟基丁酸、辅酶Q、抗病毒物质和生长促进因子,具有很高的饲料价值,在养殖业上有广阔的应用前景。 PSB在厌氧光照条件下,能利用低级脂肪酸、多种二羧酸、醇类、糖类、芳香族化合物等低分子有机物作为光合作用的电子受体,进行光能异养生长。在黑暗条件下能利用有机物作为呼吸基质进行好氧或异养生长。光合细菌不仅能在厌氧光照下利用光能同化CO2,而且还能在某些条件下进行固氮作用和在固氮酶作用下产氢。另外,有些菌种在黑暗厌氧条件下经丙酮酸代谢系统作用也可产氢。光合细菌还能利用许多有机物质如有机酸。醇、糖类转化某些有毒物质如 H2S和某些芳香族化合物等。 PSB通过生物转化,可合成无毒、无副作用且富含各类营养物质的菌体蛋白,不仅改善了生态环境,还为养殖业提供了高质量的饲料原料。 PSB菌体中对动物生长有促进作用的维生素B12、生物素、泛酸、类胡萝卜素、叶绿素以及与造血、血红蛋白形成有关的叶酸的含量远高于一般微生物,尤其含有人工不能合成的生物素D一异构体。这些物质在动物机体内都具有显著生理活性 在水产养殖中,养殖池按水中溶解氧含量的大小由表层向底部可分为好氧区和厌氧区。表层生物繁殖旺盛,水质一般较好;底层则积累了鱼虾的排泄物和未消耗尽的食物残料,有机质丰富,造成微生物的大量繁殖,消耗了水中大量的氧气,导致地底层形成无氧环境,硫酸盐还原菌大量繁殖,产生对鱼虾有毒害作用的硫化氢、酸性物质等。养殖地底层的这种环境正好是适于光合细菌生存的条件一是具有厌氧条件,二是光线通过上面覆盖的有氧水层这个光线过滤器,使光合细菌可以吸收到适宜生长的450-550μm波长光。光合细菌利用地底的鱼虾排泄物、食物残料以及有毒有害的硫化氢、酸性物质作为基质大量繁殖,提高水体中溶解氧含量,调节pH,并使氨氮。亚硝酸态氮、硝酸态氮含量降低,池底淤泥蓄积量减少,有益于藻类和微型生物数量的增加,使水体得以净化。 PSB可进行光合成、有氧呼吸、固氮、固碳等生理机能,且富含蛋白质、维生素、促生长因子、免疫因子等营养成分,在功能上可与抗生素相媲美,并且更具有安全性,是生物工程具有前景的研究领域之一。光合细菌制剂还具有独特的抗病、促生长功能,大大提高了生产性能,在应用方面显示了越来越巨大的潜力。其它在净化水质、鱼虾养殖、畜禽饲养、有机肥料及新能源的开发方面有着广阔的应用前景。